题目内容
8.若38.4gCu与一定量的浓硝酸反应,铜全部反应完后,收集到的气体在标准状况下的体积为17.92L,计算混合气体中NO2和NO的物质的量.分析 氮氧化物的物质的量=$\frac{17.92L}{22.4L/mol}=0.8mol$,根据转移电子守恒计算NO2和NO的物质的量.
解答 解:氮氧化物的物质的量=$\frac{17.92L}{22.4L/mol}=0.8mol$
设NO的物质的量为xmol,NO2的物质的量为ymol,
$\left\{\begin{array}{l}{x+y=0.8}\\{3x+y=\frac{38.4g}{64g/mol}×2}\end{array}\right.$解得:$\left\{\begin{array}{l}{x=0.2}\\{y=0.6}\end{array}\right.$
答:NO2和NO的物质的量分别为0.6mol和0.2mol.
点评 本题考查了物质的量的有关计算,根据物质间的反应并结合原子守恒进行计算,本题拿度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.烷烃  的命名正确的是( )
的命名正确的是( )
 的命名正确的是( )
的命名正确的是( )| A. | 2-甲基-3-乙基己烷 | B. | 2-甲基-3-丙基戊烷 | ||
| C. | 3-异丙基己烷 | D. | 4-甲基-3-丙基戊烷 |
19.在标准状况下进行甲、乙、丙三组实验.三组实验均各取20mL同浓度的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
请回答下列问题:
(1)要算出盐酸的物质的量浓度,题中作为计算依据的数据是乙或丙,求得的盐酸的物质的量浓度为1.5mol/L.
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是甲,求得的Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)要算出盐酸的物质的量浓度,题中作为计算依据的数据是乙或丙,求得的盐酸的物质的量浓度为1.5mol/L.
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是甲,求得的Mg、Al物质的量之比为1:1.
16.下列说法正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 分别将CuSO4、Na2CO3、KNO3、FeCl3的饱和溶液加热、蒸发后,仍能得到与原物质组成相同的晶体只有CuSO4、KNO3 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 浓度均为0.1 mol•L-1的NaClO溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 |
13.在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为( )
| A. | $\frac{Vρ}{22400}$mol•L-1 | B. | $\frac{V}{22.4}$mol•L-1 | ||
| C. | $\frac{Vρ}{22400+17V}$mol•L-1 | D. | $\frac{1000Vρ}{22400+17V}$mol•L-1 |
20.向100g浓度为c mol•L-1,密度为ρ g•cm-3的食盐水中加入一定量的水,将其稀释至0.5c mol•L-1,则加入水的体积( )
| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
17.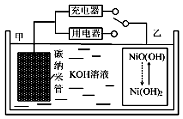 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极反应为:NiO(OH)+H2O+e?═Ni(OH)2+OH? | |
| B. | 放电时,甲电极为正极,OH?移向乙电极 | |
| C. | 电池总反应为H2+2NiO(OH)$?_{放电}^{充电}$ 2Ni(OH)2 | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |