题目内容
 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: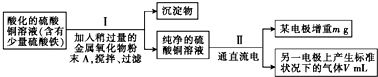
(1)步骤Ⅰ中所加A的化学式为
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是KOH溶液.肼-空气燃料电池放电时,负极产生一种无污染的气体,则负极的电极反应式是
(3)步骤Ⅱ中所用的部分仪器如图,则肼-空气燃料电池中通入肼的一端应接
(4)为达到实验目的,下列实验操作必须完成的是
A.称量电解前电极的质量
B.电解后,电极在烘干称重前必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为
考点:电解原理
专题:电化学专题
分析:(1)pH为4~5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解,加入稍过量的CuO,可以得到纯净的硫酸铜溶液,故加入CuO调节pH值,Fe3+完全水解形成Fe(OH)3沉淀而除去;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气;正极氧气发生还原反应;
(3)电解生成铜与氧气,故Cu电极连接电源的负极,则肼-空气燃料电池中通入肼的为负极应接铜电极,反应式为铜离子得电子发生还原反应;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干;
(5)根据电子转移守恒计算Cu的相对原子质量.
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气;正极氧气发生还原反应;
(3)电解生成铜与氧气,故Cu电极连接电源的负极,则肼-空气燃料电池中通入肼的为负极应接铜电极,反应式为铜离子得电子发生还原反应;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干;
(5)根据电子转移守恒计算Cu的相对原子质量.
解答:
解:(1)pH为4~5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解,加入稍过量的CuO,可以得到纯净的硫酸铜溶液,故加入CuO通过消耗H+而调整溶液的pH使之升高,使Fe3+完全水解形成Fe(OH)3沉淀而除去,
故答案为:CuO;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;O2+2H2O+4e-=4OH-;
(3)电解生成Cu与氧气,故Cu电解连接电源的负极,则肼-空气燃料电池中通入肼的为负极应接铜电极,反应式为Cu2++2e-═Cu;故答案为:铜;Cu2++2e-═Cu;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干,故需要进行ABDE操作,不需要进行C操作,
故答案为:A、B、D、E;
(5)VmL氧气的物质的量为
=
mol,设Cu的相对原子质量为Mr,根据电子转移守恒,则:
×2=
mol×4,解得Mr=
,
故答案为:
.
故答案为:CuO;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;O2+2H2O+4e-=4OH-;
(3)电解生成Cu与氧气,故Cu电解连接电源的负极,则肼-空气燃料电池中通入肼的为负极应接铜电极,反应式为Cu2++2e-═Cu;故答案为:铜;Cu2++2e-═Cu;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干,故需要进行ABDE操作,不需要进行C操作,
故答案为:A、B、D、E;
(5)VmL氧气的物质的量为
| V×10 -3L |
| 22.4L/mol |
| V |
| 22400 |
| m |
| M r |
| V |
| 22400 |
| 11200m |
| V |
故答案为:
| 11200m |
| V |
点评:本题以测定Cu的相对原子质量为载体,考查电解原理、对工艺流程的理解、常用化学用语、化学计算等,难度中等,理解工艺流程是解题的关键,需要学生具有扎实的基础与综合运用知识分析、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |
NaHCO3和Na2O2的固体混合物置于密闭容器中充分加热后,只有一种气体产物,排出该气体产物后冷却,容器内残留的固体物质中肯定有的是( )
| A、Na2O2、Na2CO3 |
| B、Na2CO3、NaOH |
| C、Na2CO3、NaHCO3 |
| D、Na2CO3、Na2O2、NaOH |

 如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: