��Ŀ����
 �ס��ҡ����������졢��Ϊԭ��������������Ķ���������Ԫ�أ��ס�������ͬһ���壬���������촦��ͬһ���ڣ���Ԫ������ϼ�����ͼ۵Ĵ�����Ϊ0�����������������������ˮ����֮�䶼�ܷ�����Ӧ���û�ѧ����ش��������⣺
�ס��ҡ����������졢��Ϊԭ��������������Ķ���������Ԫ�أ��ס�������ͬһ���壬���������촦��ͬһ���ڣ���Ԫ������ϼ�����ͼ۵Ĵ�����Ϊ0�����������������������ˮ����֮�䶼�ܷ�����Ӧ���û�ѧ����ش��������⣺��1���������ӵĽṹʾ��ͼΪ
��2����������������Ӱ뾶�ɴ�С��˳��Ϊ
��3��д���ɼ�����Ԫ���γɵĻ������У��Ⱥ��м��Լ��ֺ��зǼ��Լ�������Է���������С�����ʵĽṹʽ
��4��������������������ˮ����֮�䷢����Ӧ�����ӷ���ʽΪ
��5������ͼ�����ͼ��γɻ�����ı�����Һ����װ�ÿ����ڼ�ͥ��ˮ��������д���õ����з�����Ӧ���ܷ�Ӧ����ʽ��
���㣺λ�ýṹ���ʵ����ϵӦ��
ר�⣺Ԫ����������Ԫ�����ڱ�ר��
�������ס��ҡ����������졢��Ϊԭ��������������Ķ���������Ԫ�أ����������������������ˮ����֮�䶼�ܷ�����Ӧ����Ϊ��Ԫ�أ���Ϊ����ȣ������ڵ�����������滹�м���������Ϊ��Ԫ�أ���Ϊ��Ԫ�أ����������촦��ͬһ���ڣ���Ϊ�������ڣ���ס���Ϊǰ������Ԫ�أ���Ԫ������ϼ�����ͼ۵Ĵ�����Ϊ0������Ϊ̼Ԫ�أ�������Ԫ���γɵĻ������У��Ⱥ��м��Լ��ֺ��зǼ��Լ������Ϊ��Ԫ�أ��ס�������ͬһ���壬��Ϊ��Ԫ�أ��ݴ˴��⣮
���
�⣺�ס��ҡ����������졢��Ϊԭ��������������Ķ���������Ԫ�أ����������������������ˮ����֮�䶼�ܷ�����Ӧ����Ϊ��Ԫ�أ���Ϊ����ȣ������ڵ�����������滹�м���������Ϊ��Ԫ�أ���Ϊ��Ԫ�أ����������촦��ͬһ���ڣ���Ϊ�������ڣ���ס���Ϊǰ������Ԫ�أ���Ԫ������ϼ�����ͼ۵Ĵ�����Ϊ0������Ϊ̼Ԫ�أ�������Ԫ���γɵĻ������У��Ⱥ��м��Լ��ֺ��зǼ��Լ������Ϊ��Ԫ�أ��ס�������ͬһ���壬��Ϊ��Ԫ�أ�
1����Ϊ�⣬���������ӵĽṹʾ��ͼΪ ���õ���ʽ��ʾ����̼���γɻ�����Ĺ���Ϊ
���õ���ʽ��ʾ����̼���γɻ�����Ĺ���Ϊ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��2�����Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬʱ���˵����Խ�࣬�뾶ԽС�����Ա�������������Ӱ뾶�ɴ�С��˳��ΪS2-��Na+��Al3+��Ԫ�صķǽ�����Խ������Ӧ ���⻯�ﻹԭ��Խǿ���������ҡ��졢�����⻯���л�ԭ����������HCl��
�ʴ� Ϊ��S2-��Na+��Al3+��HCl��
��3����C��H��Ԫ���γɵĻ������У��Ⱥ��м��Լ��ֺ��зǼ��Լ�������Է���������С������Ϊ��Ȳ�����ĽṹʽΪH-C��C-H����Ȳ����������������¿ɹ���ȼ�ϵ�أ��õ�طŵ�ʱ��Ȳ����ԭ���ڸ�������������Ӧ�������ķ�ӦʽΪ C2H2+4H2O-10e-=2CO2+10H+��
�ʴ�Ϊ��H-C��C-H�� C2H2+4H2O-10e-=2CO2+10H+��
��4��������������������֮�䷢����Ӧ�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O���ɼס������졢���в���Ԫ���γɵ����ֻ������ˮ��Һ֮����Է�����Ӧ������������Ϊ�Ȼ�������ƻ����⻯�ƣ��û�ѧ����ʽΪ��NaHS+HCl=NaCl+H2S �� Na2S+H2S=2 NaHS��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��NaHS+HCl=NaCl+H2S �� Na2S+H2S=2 NaHS��
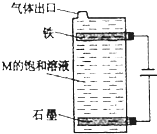
��5������ͼ����Ȼ��Ƶı�����Һ�����������������������Լ����������������������ٷ�Ӧ���ɴ������ƺ��Ȼ��ƣ������з�����Ӧ���ܷ�Ӧ����ʽΪNaCl+H2O
NaClO+H2����
�ʴ�Ϊ��NaCl+H2O
NaClO+H2����
1����Ϊ�⣬���������ӵĽṹʾ��ͼΪ
 ���õ���ʽ��ʾ����̼���γɻ�����Ĺ���Ϊ
���õ���ʽ��ʾ����̼���γɻ�����Ĺ���Ϊ ��
���ʴ�Ϊ��
 ��
�� ��
����2�����Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬʱ���˵����Խ�࣬�뾶ԽС�����Ա�������������Ӱ뾶�ɴ�С��˳��ΪS2-��Na+��Al3+��Ԫ�صķǽ�����Խ������Ӧ ���⻯�ﻹԭ��Խǿ���������ҡ��졢�����⻯���л�ԭ����������HCl��
�ʴ� Ϊ��S2-��Na+��Al3+��HCl��
��3����C��H��Ԫ���γɵĻ������У��Ⱥ��м��Լ��ֺ��зǼ��Լ�������Է���������С������Ϊ��Ȳ�����ĽṹʽΪH-C��C-H����Ȳ����������������¿ɹ���ȼ�ϵ�أ��õ�طŵ�ʱ��Ȳ����ԭ���ڸ�������������Ӧ�������ķ�ӦʽΪ C2H2+4H2O-10e-=2CO2+10H+��
�ʴ�Ϊ��H-C��C-H�� C2H2+4H2O-10e-=2CO2+10H+��
��4��������������������֮�䷢����Ӧ�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O���ɼס������졢���в���Ԫ���γɵ����ֻ������ˮ��Һ֮����Է�����Ӧ������������Ϊ�Ȼ�������ƻ����⻯�ƣ��û�ѧ����ʽΪ��NaHS+HCl=NaCl+H2S �� Na2S+H2S=2 NaHS��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��NaHS+HCl=NaCl+H2S �� Na2S+H2S=2 NaHS��
��5������ͼ����Ȼ��Ƶı�����Һ�����������������������Լ����������������������ٷ�Ӧ���ɴ������ƺ��Ȼ��ƣ������з�����Ӧ���ܷ�Ӧ����ʽΪNaCl+H2O
| ||
�ʴ�Ϊ��NaCl+H2O
| ||
������������Ҫ�����˵���ʽ��Ԫ�������ɡ�ԭ��ط�Ӧ�����ط�Ӧ��֪ʶ����һ�����ۺ��ԣ��е��Ѷȣ�Ԫ���ƶ��ǽ���Ĺؼ�������ʱע�ⳣ��Ԫ�ػ�����֪ʶ��������ã�

��ϰ��ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A����ͬ���ʵ���Ũ�ȵ�������Һ�У���NH4Al��SO4��2����NH4Cl����CH3COONH4����NH3?H2O��c��NH4+���ɴ�С��˳���ǣ��٣��ڣ��ۣ��� |
| B��ij���ʵ���Һ����ˮ�������c��H+��=1��10-amol/L����a��7ʱ�������Һ��pHһ��Ϊ14-a |
| C�����ʵ���Ũ����ȵ�H2S��NaHS�����Һ�У�c��Na+��+c��H+��=c��S2-��+c��HS-��+c��OH-��? |
| D��AgCl����Һ�д���ƽ�⣺AgCl��s��?Ag+��aq��+Cl- ��aq���������м�������NaCl��ĩ��ƽ��������ƶ�����Һ�����ӵ���Ũ�Ȼ��С |
һ�������½��з�Ӧ��COCl2��g��?Cl2��g��+CO��g������2.0L�����ܱ������г���1.0 mol COCl2��g��������һ��ʱ���ﵽƽ�⣮��Ӧ�����в�õ��й����ݼ��±���
����˵����ȷ���ǣ�������
| t/s | 0 | 2 | 4 | 6 | 8 |
| n��Cl2��/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A��A�����������������䣬�����¶ȣ�ƽ��ʱc��Cl2��=0.22 mol?L-1����Ӧ�ġ�H��0 |
| B������2 L���ݾ��ȣ������û�������������ܱ��������и÷�Ӧ����ѧƽ�ⳣ������ |
| C�����������������䣬��ʼ�������г���1.2 molCOCl2��0.60 molCl2��0.60 molCO����Ӧ�ﵽƽ��ǰ�����ʣ�v��������v���棩 |
| D�����������������䣬��ʼ�������г���1.0 molCl2��0.8 molCO���ﵽƽ��ʱ��Cl2��ת����С��60% |
ˮ�����������������Ҫ���ʣ�ˮ��Ⱦȴ����Ӱ������������滷����Ŀǰ��ˮ��Ⱦ��Ҫ���� ��������
�ٹ�ҵ�����з�������Һ�������ŷ�
��ũҵ������ũҩ�����ʵĹ���ʹ��
�۳���������ˮ�������ŷ�
�����������ͷϾɵ�ص����ⶪ����
�ٹ�ҵ�����з�������Һ�������ŷ�
��ũҵ������ũҩ�����ʵĹ���ʹ��
�۳���������ˮ�������ŷ�
�����������ͷϾɵ�ص����ⶪ����
| A���٢� | B���ڢۢ� |
| C���٢ۢ� | D���٢ڢۢ� |
���л�ѧ����ʽ��д�����ӷ���ʽ����ȷ���ǣ�������
| A��CuCl2+2NaOH�TCu��OH��2��+2NaCl��Cu2++20H�TCu��OH��2�� |
| B��BaSO4+2HCl�TBaCl2+CO2��+H2O��SO42-+2H+�TCO2��+H2O |
| C��Ca��NO3��2+Na2CO3�TCaCO3��+2NaNO3 Ca2++CO32-�TCaCO3�� |
| D��2KOH+H2SO4�TK2SO4+2H2O��H++OH-�TH2O |
 W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ���ǣ�������
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ���ǣ�������| A��������YZ4�Ȼ�����XZ�۵�� |
| B��W��X��W��Z�����γ�ij�־���Ư���ԵĻ������ԭ����ͬ |
| C��������X2YW3�Ⱥ����Ӽ����ֺ����ۼ�������ճ�����ͷ���� |
| D��Y����������Z���⻯�X������������Ӧ��ˮ�������Һ���ܷ�Ӧ |
Ϊ�˷�ֹFeSO4�����������ʣ�ʵ����������FeSO4��Һʱ��������Һ�м��������ģ�������
| A��ͭ�� |
| B������ |
| C��� |
| D��Fe3��SO4��3 |