题目内容
12.现有一块已知质量为mg的镁铝合金,欲测定其中铝的质量分数,几位同学设计了以下几种不同的实验方案:方案Ⅰ:镁铝合金$\stackrel{足量NaOH溶液}{→}$过滤、洗涤、干燥→测定剩余固体质量m1g
方案Ⅱ:镁铝合金$\stackrel{足量盐酸}{→}$生成气体在标准状况下的体积为VL
方案Ⅲ:镁铝合金$\stackrel{足量盐酸}{→}$溶液$\stackrel{足量NaOH溶液}{→}$过滤、洗涤、干燥→测定沉淀质量m2g
请回答以下问题:
(1)上述方案能测定出铝的质量分数的是A
A.都能 B.Ⅰ不能,Ⅱ和Ⅲ能
C.Ⅱ不能,Ⅰ和Ⅲ能 D.Ⅰ和Ⅱ不能,Ⅲ能
(2)如果方案Ⅲ过滤得到沉淀没有洗涤、干燥,测得铝的质量分数会偏小(填“偏大”、“偏小”或“无影响”)
(3)某同学综合上述方案,设计如图1所示的实验步骤,确定合金组成.
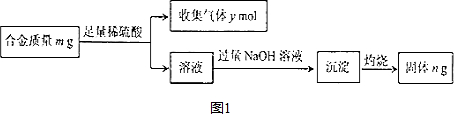
①用字母m、n表示合金中铝的质量分数为$\frac{5m-3n}{5m}$.
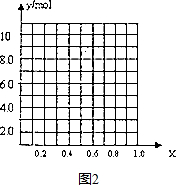
②若合金中Al的物质的量分数为x,金属总物质的量为6mol,试在图2中作出y随x变化的曲线.当y=7.5mol时,该合金中镁铝的原子数之比为1:1.
分析 (1)实验设计Ⅰ:只有铝与氢氧化钠溶液反应,生成氢气,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计Ⅱ:Mg、Al均与盐酸反应,生成H2,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计Ⅲ:Mg、Al与盐酸反应后,再加入过量NaOH溶液,Mg2+生成Mg(OH)2沉淀,Al3+生成NaAlO2溶液,根据Mg(OH)2沉淀的质量,可求出镁的质量分数;
(2)如果方案Ⅲ过滤得到沉淀没有洗涤、干燥,则测得的Mg(OH)2沉淀的质量偏大,据此分析;
(3)①合金加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,结合样品的质量则可知铝的质量分数;
②利用端值法判断;
③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则m+n=7 m+1.5n=8.5,解得m=4,n=3.
解答 解:(1)实验设计Ⅰ:只有铝与氢氧化钠溶液反应,生成氢气,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计Ⅱ:Mg、Al均与盐酸反应,生成H2,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计Ⅲ:Mg、Al与盐酸反应后,再加入过量NaOH溶液,Mg2+生成Mg(OH)2沉淀,Al3+生成NaAlO2溶液,根据Mg(OH)2沉淀的质量,可求出镁的质量分数,
所以上述三个方案都能测定出铝的质量分数,故选A;
(2)如果方案Ⅲ过滤得到沉淀没有洗涤、干燥,则测得的Mg(OH)2沉淀的质量偏大,所以测得镁的质量分数会偏大,即测得铝的质量分数偏小,
故答案为:偏小;
(3 )①合金加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量ng,可知镁的质量为$\frac{24}{40}$×ng=0.6ng,所以铝的质量分数为$\frac{mg-0.6ng}{mg}$=$\frac{5m-3n}{5m}$,
故答案为:$\frac{5m-3n}{5m}$;
②Al的物质的量分数为x,金属总物质的量为6mol,如x=0,则全被为镁,6mol镁反应生成6mol氢气,如x=1,则全被为铝,则6mol铝生成氢气9mol,则图象为 ,当y=7.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则m+n=6 m+1.5n=7.5,解得m=3,n=3,所以该合金中镁铝的原子数之比为1:1,
,当y=7.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则m+n=6 m+1.5n=7.5,解得m=3,n=3,所以该合金中镁铝的原子数之比为1:1,
故答案为: ;1:1.
;1:1.
点评 本题考查化学实验方案的评价,涉及镁和铝的化学性质、化学实验方案的设计,物质含量测定、化学计算等,掌握镁和铝的化学性质是解题的关键,侧重于考查学生的实验能力和分析能力,注意根据物质的性质进行判断,题目难度中等.

| A. | OH- | B. | H+ | C. | SO42- | D. | SCN- |
| A. | 氧化还原反应中,非金属单质一定被还原 | |
| B. | 由H2O2→O2的过程一定需加入氧化剂才能实现 | |
| C. | 置换反应都属于氧化还原反应,反应物中的单质一定作还原剂 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
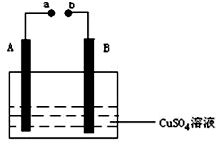 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则: