题目内容
19.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3.下列关系或者说法错误的是( )| A. | c(CO32-)的大小关系为:②>⑤>③>④>① | |
| B. | 将溶液蒸干灼烧只有②能得到对应的固体物质 | |
| C. | ③④⑤既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | c(HCO3-)的大小关系为:④>③>⑤>②>① |
分析 ①H2CO3为二元弱酸,不稳定,加热易分解,碳酸为弱电解质,在水溶液中分两步电离,以第一步为主;
②碳酸钠为强电解质,性质稳定,水溶液中水解显碱性;
③碳酸氢钠是强碱弱酸盐的酸式盐,水解呈碱性,且水解程度比碳酸钠小,具有不稳定性受热易分解;
④NH4HCO3溶液中是弱酸弱碱的酸式盐,发生相互促进的水解,具有不稳定性;
⑤(NH4)2CO3是弱酸弱碱盐,发生相互促进的水解,具有不稳定性,受热易分解.
解答 解:A.②⑤相比较,⑤发生互促水解,c(CO32-)的大小为②>⑤,③④以水解为主,且④发生互促水解,c(CO32-)较小,①为二元弱酸,c(CO32-)最小,则c(CO32-)的大小关系为Na2CO3>(NH4)2CO3>NaHCO3>NH4HCO3>H2CO3,故A正确;
B.①③④⑤性质都不稳定,受热都容易分解,将溶液蒸干灼烧得不到对应的固体物质,②性质稳定,将溶液蒸干灼烧得不到对应的固体物质,故B正确;
C.碳酸氢钠为弱酸的酸式盐、碳酸氢铵为弱酸的酸式盐、碳酸铵为弱酸的铵盐,都能既能与盐酸反应,又能与NaOH溶液反应,故C正确;
D.③④相比较,④发生互促水解,c(HCO3-)③>④,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,明确电解质强弱及电离方式,盐类水解规律是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9. 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )| A. | Al粉作为氧化剂 | B. | Al被氧化 | C. | Al发生还原反应 | D. | Al得到电子 |
7.下列说法正确的是( )
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
14.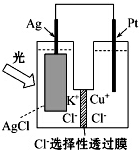 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
4.可逆反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),升高温度对该反应产生的影响是( )
| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
18.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )
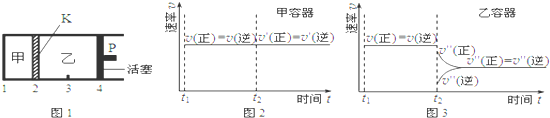

| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
19.海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
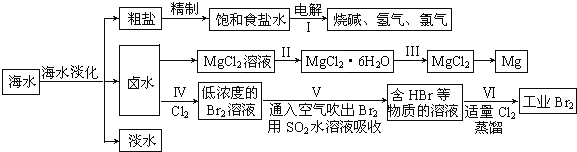
(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).
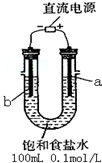
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是ad(填序号,下同),加入e调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(三)制取工业溴:
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.

(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).

(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质. .
.