题目内容
7. 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) ①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
分析 Zn-Cu原电池中,电池总反应为Zn+2H+=Zn2++H2↑,Zn作负极,失电子发生氧化反应,铜作正极,氢离子在铜上得电子产生氢气,电子由负极经导线流向正极,阴离子移向负极,阳离子移向正极,据此解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②H+向正极移动,故②错误;
③电子是由Zn经外电路流向Cu,故③正确;
④Cu电极上发生2H++2e-=H2↑,产生氢气,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,质量为1g,故⑤正确;
⑥正极反应为2H++2e-=H2↑,故⑥错误;
故选B.
点评 本题考查了原电池的工作原理,为高频考点,侧重于基础知识的考查,注意把握原电池的工作原理,题目难度不大.

练习册系列答案
相关题目
18.下列两组反应,反应类型相同的是( )
| 组别 | Ⅰ | Ⅱ |
| A | 常温下,乙烯和氯气混合 | 乙烷和氯气混合光照 |
| B | 乙酸、乙醇、浓硫酸混合,加热 | 在FeBr3催化下,苯与液溴反应 |
| C | 苯和浓硫酸、浓硝酸混合,加热到50~60℃ | 乙烯在一定条件下与水反应 |
| D | 由乙烯制取聚乙烯 | 蔗糖与稀硫酸混合,加热 |
| A. | A | B. | B | C. | C | D. | D |
18.下列图象不符合事实是( )
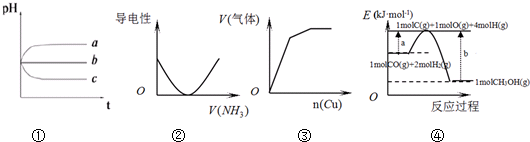

| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
15.下列各组物质中,化学键类型完全相同的是( )
| A. | HCl、CaCl2 | B. | H2O2、Na2O2 | C. | NaOH、H2O | D. | CO2、CH4 |
2.下列说法中不正确的是( )
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
| A. | ①④⑥⑦ | B. | ③④⑥⑦ | C. | ①②④⑥⑦ | D. | ①②⑥⑦ |
12.下列说法正确的是( )
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
19.已知H2A为二元弱酸,室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,下列指定溶液中微粒的物质的量浓度关系不正确的是( )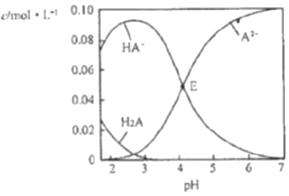

| A. | pH=2的溶液中:c(H2A)+c(A2-)>c(HA-) | |
| B. | E点溶液中:c(Na+)-c(HA-)<0.100mol•L-1 | |
| C. | c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2A)=c(OH-)+c(A2-) | |
| D. | pH=7的溶液中:c(Na+)>2c(A2-) |
17.下列不能用于鉴别SO2和CH4两种无色气体的试剂是( )
| A. | 氢氧化钠溶液 | B. | 品红溶液 | ||
| C. | 澄清石灰水 | D. | 酸性高锰酸钾溶液 |
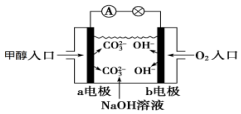 如图是甲醇燃料电池原理示意图,请回答下列问题:
如图是甲醇燃料电池原理示意图,请回答下列问题: