题目内容
18.下列图象不符合事实是( )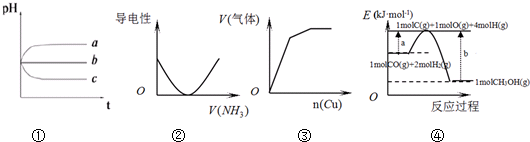
| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
分析 A.pH相同的三种酸性溶液,由图象可知,a的pH变大,b的pH不变,c的pH减小,则露置于空气中一段时间,a可能被氧化,b为不挥发的强酸,c中氢离子浓度增大,以此来解答;
B.乙酸为弱电解质,与氨气反应生成醋酸铵为强电解质;
C.Cu与浓硝酸反应生成二氧化氮,与稀硝酸反应生成NO;
D.△H=正反应的活化能-逆反应的活化能.
解答 解:A.H2S溶液被氧化生成水和S,其pH增大,稀H2SO4溶液不发生变化,其pH不变,而H2SO3溶液被氧化生成硫酸,氢离子浓度增大,其pH减小,与图象一致,故A正确;
B.乙酸为弱电解质,溶液的导电能力较弱,与氨气反应生成醋酸铵为强电解质,溶液的导电能力增强,图中曲线变化趋势错误,故B错误;
C.铜先和浓硝酸反应生成二氧化氮气体,随着反应的进行,浓硝酸变成稀硝酸,铜和稀硝酸反应生成一氧化氮,当硝酸完全反应时,生成的气体为定值,故C正确;
D.△H=正反应的活化能-逆反应的活化能,则合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)kJ•mol-1=(a-b )kJ•mol-1,故D正确;
故选B.
点评 本题考查了图象的分析和应用,涉及元素化合物的性质、溶液的导电性、反应热等,题目难度中等,侧重于考查学生的读图能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
9.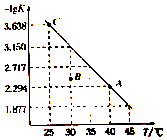 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |
10.火山爆发产生的气体中含有少量的羰基硫(分子式是:COS),已知羰基硫分子结构与CO2类似,有关说法正确的是( )
| A. | 羰基硫是电解质 | B. | 羰基硫分子的电子式为: | ||
| C. | C、O、S三个原子中半径最小的是C | D. | 羰基硫分子为非极性分子 |
6.125℃时在容积不变的容器中:W、X、Y、Z的浓度变化如表:下列叙述中正确的是( )
| 物质 | W(g) | X(g) | Y(g) | Z(g) |
| 初始浓度(mol/L) | 4.0 | 2.0 | 0 | 0 |
| 2min末浓度(mol/L) | 2.4 | 1.2 | 0.8 | 1.6 |
| A. | 2min内X的平均速率为0.6mol/(L•min) | |
| B. | 该反应的化学方程式可表示为:2W(g)+X(g)?2Y+Z | |
| C. | 若达到平衡后保持压强不变充入Ne,平衡不移动 | |
| D. | 平衡后再加入W,则W的转化率增大 |
13.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了3.4g,则反应速率为( )
| A. | v(H2)=0.05mol/(L•min) | B. | v(N2)=0.03mol/(L•min) | ||
| C. | v(NH3)=0.17g/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
10.下列有关实验的说法中,正确的是( )
| A. | 钾的燃烧实验需用到的实验仪器除镊子、坩埚外,还需 2 种仪器即:三脚架和酒精灯 | |
| B. | 向盛 Na2SiO3 溶液的试管中滴加 1 滴酚酞,然后逐滴加入稀盐酸至红色褪去2 min后,试管里出现凝胶,则说明非金属性:Cl>Si | |
| C. | 金属性 K>Na,则钾可将 NaCl 溶液中的 Na 置换出来 | |
| D. | 欲鉴别乙烯和乙烷,可将二者分别通入高锰酸钾酸性溶液 |
7. 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) ①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
8.下列关系正确的是( )
| A. | 熔、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CH3CH2Br>H2O>甲苯 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸 |
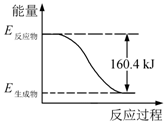 2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图.
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图.