题目内容
19.已知H2A为二元弱酸,室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,下列指定溶液中微粒的物质的量浓度关系不正确的是( )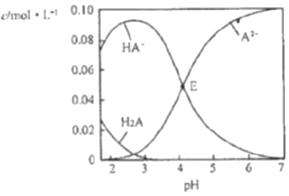
| A. | pH=2的溶液中:c(H2A)+c(A2-)>c(HA-) | |
| B. | E点溶液中:c(Na+)-c(HA-)<0.100mol•L-1 | |
| C. | c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2A)=c(OH-)+c(A2-) | |
| D. | pH=7的溶液中:c(Na+)>2c(A2-) |
分析 A.根据图知,pH=2时,c(A2-)接近于0,c(H2A)小于0.02mol/L、c(HA-)大于0.08mol/L;
B.E点溶液中c(H2A)=0,c(A2-)=c(HA-)=0.05mol/L,溶液的pH<7,c(H+)>c(OH-),根据电荷守恒得c(Na+)<2c(A2-)+c(HA-),则c(Na+)-c(HA-)<2c(A2-);
C.c(Na+)=0.100mol•L-1的溶液中,溶液中存在c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1,则溶液中存在物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(H2A)+c(HA-)+2c(A2-),根据电荷守恒和物料守恒判断;
D.pH=7时,c(H+)=c(OH-),溶液中c(HA-)=0,根据电荷守恒判断.
解答 解:A.根据图知,pH=2时,c(A2-)接近于0,c(H2A)小于0.02mol/L、c(HA-)大于0.08mol/L,所以存在(H2A)+c(A2-)<c(HA-),故A错误;
B.E点溶液中c(H2A)=0,c(A2-)=c(HA-)=0.05mol/L,溶液的pH<7,c(H+)>c(OH-),根据电荷守恒得c(Na+)<2c(A2-)+c(HA-),则c(Na+)-c(HA-)<2c(A2-)=0.100mol/L,故B正确;
C.c(Na+)=0.100mol•L-1的溶液中,溶液中存在c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1,则溶液中存在物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(H2A)+c(HA-)+2c(A2-),根据电荷守恒、物料守恒得c(H+)=c(OH-)+c(A2-),故C错误;
D.pH=7时,c(H+)=c(OH-),溶液中c(HA-)=0,根据电荷守恒得c(Na+)=2c(A2-),故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、判断及计算能力,明确溶液中溶质成分及其相对大小、溶液的pH、溶液中存在的守恒是解本题关键,注意C中物料守恒的等量代换,为易错点.

| A. | 羰基硫是电解质 | B. | 羰基硫分子的电子式为: | ||
| C. | C、O、S三个原子中半径最小的是C | D. | 羰基硫分子为非极性分子 |
| A. | 钾的燃烧实验需用到的实验仪器除镊子、坩埚外,还需 2 种仪器即:三脚架和酒精灯 | |
| B. | 向盛 Na2SiO3 溶液的试管中滴加 1 滴酚酞,然后逐滴加入稀盐酸至红色褪去2 min后,试管里出现凝胶,则说明非金属性:Cl>Si | |
| C. | 金属性 K>Na,则钾可将 NaCl 溶液中的 Na 置换出来 | |
| D. | 欲鉴别乙烯和乙烷,可将二者分别通入高锰酸钾酸性溶液 |
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) ①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
| A. | 氢氧化物呈两性 | B. | 单质与水反应放出氢气 | ||
| C. | 在化合物中呈+2价 | D. | 单质的还原性比镁强 |
| A. | NH4HSO3与NaOH等物质的量反应:NH4++HSO3-+2OH-═NH3•H2O+SO32- | |
| B. | 铜与浓硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 过量SO2通入次氯酸钠溶液:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| A. | 氟乙酸甲酯仅含有一种官能团 | |
| B. | 氟乙酸甲酯的同分异构体属于羧酸类的有3种 | |
| C. | lmol氟乙酸甲酯与NaOH水溶液共热最多消耗2molNaOH | |
| D. | 氟乙酸甲酯加入稀硫酸共热后生成的有机物是HOCH2COOH和CH3OH |
| A. | 熔、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CH3CH2Br>H2O>甲苯 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸 |
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 2.0 | 0 |
| 2s末浓度(mol/L) | 0.6 | 0.4 | 0.8 |
| A. | 3:1:2 | B. | 3:2:1 | C. | 2:1:3 | D. | 9:3:4 |