题目内容
 0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:A. 移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E.调节液面至0或0以下刻度,记下读数为1.15mL
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度读数为如下图示
G.把锥形瓶里的溶液倒掉,用蒸馏水把锥形瓶洗涤干净.按上述操作重复一次,并记下滴定前后液面刻度的读数.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)
(2)F操作中记录下的正确读数为
A.22.30mL B.22.35mL
C.23.65mL D.23.70Ml
(3)判断到达滴定终点的实验现象是:
(4)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(5)A步移取20.00mL待测盐酸溶液注入洁净的锥形瓶时,滴定管液体前无气泡,放完液体后出现气泡,对滴定结果的影响是
(6)若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是
考点:中和滴定
专题:实验题
分析:(1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定、重复2-3次等操作;
(2)根据滴定管的结构与精确度为0.01mL;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)(5)(6)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断;
(2)根据滴定管的结构与精确度为0.01mL;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)(5)(6)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
解答:
解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.再取待测液于锥形瓶,然后加入指示剂进行滴定,重复上述操作2-3次,所以顺序为:BCDEAFG;
故答案为:BCDEAFG;
(2)滴定后,滴定管中的液面读数为22.35mL;
故选B;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,故答案为:滴入最后一滴NaOH溶液,溶液颜色从无色变为粉红色,并保持半分钟不退色;
(4)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=
分析,会造成c(待测)偏高;
故答案为:偏高;
(5)A步移取20.00mL待测盐酸溶液注入洁净的锥形瓶时,滴定管液体前无气泡,放完液体后出现气泡,会造成V(标准)偏大,根据c(待测)=
分析,会造成c(待测)偏高;
故答案为:偏高;
(6)称取一定量的KOH固体(含少量NaOH),等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小,由c(待测)=
分析,c(待测)偏低;
故答案为:偏低;
故答案为:BCDEAFG;
(2)滴定后,滴定管中的液面读数为22.35mL;
故选B;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,故答案为:滴入最后一滴NaOH溶液,溶液颜色从无色变为粉红色,并保持半分钟不退色;
(4)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故答案为:偏高;
(5)A步移取20.00mL待测盐酸溶液注入洁净的锥形瓶时,滴定管液体前无气泡,放完液体后出现气泡,会造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故答案为:偏高;
(6)称取一定量的KOH固体(含少量NaOH),等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小,由c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故答案为:偏低;
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及误差分析,把握实验基本操作.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A、3种元素的气态氢化物中,Z的气态氢化物最稳定 |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、元素非金属性由弱到强的顺序为Z<Y<X |
| D、原子半径由大到小的顺序为X>Y>Z |
关于阿伏加德罗常数的说法正确的是( )
| A、0.1 L 3.0 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| B、9g SiO2晶体中含有的硅氧键数目为0.3NA |
| C、30 g甲醛中含共用电子对总数为4NA |
| D、10 g 46%的乙醇水溶液中所含H原子个数为0.6NA |
下列化学用语或模型图正确的是( )
| A、HClO的结构式:H-Cl-O |
B、CO2的比例模型: |
C、146C的原子结构示意图: |
D、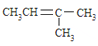 的名称:3-甲基-2-丁烯 的名称:3-甲基-2-丁烯 |
根据图式,下列热化学方程式书写正确的是( )
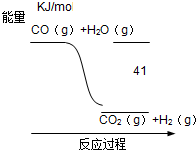

| A、CO+H2O═CO2+H2 △H=-41 KJ/mol |
| B、CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41 KJ/mol |
| C、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41 KJ/mol |
| D、CO2(g)+H2(g)═CO(g)+H2O(g)△H=-41 KJ/mol |
下列说法中正确的是( )
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |
四种短周期元素W、X、Y、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,X和Y的电子数之差为4.下列说法正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D、Y、Z所形成的氧化物的水化物的酸性为:Y<Z |