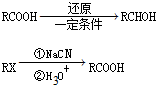
题目内容
根据图式,下列热化学方程式书写正确的是( )
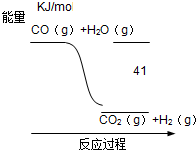

| A、CO+H2O═CO2+H2 △H=-41 KJ/mol |
| B、CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41 KJ/mol |
| C、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41 KJ/mol |
| D、CO2(g)+H2(g)═CO(g)+H2O(g)△H=-41 KJ/mol |
考点:化学反应的能量变化规律,反应热和焓变
专题:
分析:根据图象可以看出,CO(g)+H2O(g)与CO2(g)+H2(g)的能量的高低,故可得出反应的吸放热情况,然后根据能量相差41KJ/mol,即可写出热化学方程式.
解答:
解:A、热化学方程式必须标注物质的状态,故A错误;
B、反应热△H必须带正负号,故B错误;
C、当CO2(g)+H2(g)=CO(g)+H2O(g)时,反应物的总能量小于生成物的总能量,反应吸热,故△H大于0,故C正确;
D、当CO2(g)+H2(g)=CO(g)+H2O(g)时,反应物的总能量小于生成物的总能量,故反应为吸热,故△H应为正值,故D错误;
故选C.
B、反应热△H必须带正负号,故B错误;
C、当CO2(g)+H2(g)=CO(g)+H2O(g)时,反应物的总能量小于生成物的总能量,反应吸热,故△H大于0,故C正确;
D、当CO2(g)+H2(g)=CO(g)+H2O(g)时,反应物的总能量小于生成物的总能量,故反应为吸热,故△H应为正值,故D错误;
故选C.
点评:反应吸放热可以从反应物和生成物的总能量的角度来进行判断.如反应物的总能量高于生成物的总能量,则放热,反之则吸热.注意反应吸放热的表示方法,题目难度不大.

练习册系列答案
相关题目
下列物质中属于有机物的是( )
| A、碳酸 | B、二氧化碳 | C、煤 | D、甲烷 |
下列有关氯水的叙述,正确的是( )
| A、氯气有毒,可以毒死细菌、病毒,所以可以用于自来水消毒 |
| B、新制氯水可使紫色石蕊试液先变红后褪色 |
| C、氯水光照时有气泡逸出,该气体的主要成分是氯气 |
| D、氯水放置数天后,其酸性逐渐减弱 |
下列有关实验中安全操作或事故处理中正确的是 ( )
| A、将100g水倒入100g 98% 硫酸溶液中配制成49% 的硫酸溶液 |
| B、给试管里的液体加热时,液体体积不得超过试管容积的1/3 |
| C、使用胶头滴管时,应将滴管尖嘴伸进试管内,以免液体外流 |
| D、不小心将浓硫酸洒到桌面上,应先用抹布擦,再用大量水冲洗 |
 0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步: )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.