题目内容
10. 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+(滴定时,1mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是溶液由无色变为粉红,且保持半分钟不变色.
⑤如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析 (1)①滴定管需要要NaOH溶液润洗,否则会导致溶液浓度偏低,体积偏大;
②锥形瓶内是否有水,溶质的物质的量不变;
③滴定时眼睛应注意注意观察颜色变化,以确定终点;
④氢氧化钠滴定酸溶液,酚酞颜色变化为无色变化为红色;
⑤依据滴定管刻度为0.01ml读数;
(2)标准溶液的体积应取三次实验的平均值,根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,根据n=cV计算消耗氢氧化钠的物质的量,进而计算H+[含(CH2)6N4H+]的物质的量,根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,据此计算铵根离子物质的量,再计算氮元素的质量,据此计算解答.
解答 解:(1)①碱式滴定管用蒸馏水洗涤后需要再用NaOH溶液润洗,否则相当于NaOH溶液被稀释,滴定消耗的体积会偏高,测得样品中氮的质量分数也将偏高,
故答案为:偏高;
②锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,溶液的体积不变,
故答案为:无影响;
③定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点,故答案为:B;
④氢氧化钠滴定酸溶液,滴定终点时,溶液从无色变为浅红色,30s内不褪色,
故答案为:溶液由无色变为粉红,且保持半分钟不变色;
⑤滴定管是精密量具,读取数值为0.01ml,结合图中液面变化得到此时读数为22.60mL,
故答案为:22.60;
(2)标准溶液的体积应取三次实验的平均值,首先确定滴定时所用的NaOH标准溶液为$\frac{20.01+19.99+20.00}{3}$mL=20.00mL,根据题意中性甲醛溶液一定是过量的,而且1.500g铵盐经溶解后,取了其中$\frac{1}{10}$进行滴定,即0.15g,滴定结果,溶液中含有H+(含(CH2)6N4H+)共0.02L××0.1050mol/L=0.0021mol,根据4NH4++6HCHO═3H++6H2O+(CH2)6N4H+,每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol,所以共消耗NH4+0.0021mol,其中含氮元素0.0021mol×14g/mol=0.0294g
所以氮的质量分数为$\frac{0.0294}{0.15}$×100%=19.6%,
故答案为:19.6%.
点评 本题考查物质的含量的测定,侧重于中和滴定的考查,注重于学生实验能力和分析能力和计算能力的综合考查,题目难度中等.

| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
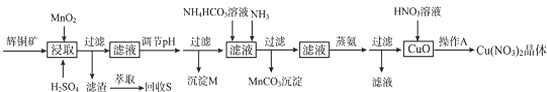
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnCO3沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85%Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损失Cu3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6kg这样的辉铜矿最多能制备14.9mol无水Cu(NO3)2.(计算结果精确到小数点后1位)
| A. | CH4+Cl$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3COOCH2CH3$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH |
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.