题目内容
19.反应N2(g)+3H2(g)?2NH3(g)在密闭容器中进行.下列关于该反应的说法正确的是( )| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
分析 该反应为可逆反应,反应物的转化率不可能达到100%,结合浓度、温度、催化剂对反应速率的影响解答该题.
解答 解:A.升高温度能增大反应速率,则降低温度减小反应速率,故A错误;
B.增大压强,反应物的浓度增大,反应速率增大,故B正确;
C.反应达到平衡时,正逆反应速率相等,但不等于0,故C错误;
D.该反应为可逆反应,反应物的转化率不可能达到100%,故D错误.
故选B.
点评 本题考查化学反应速率的影响,为高频考点,题目较为基础,注意可逆反应的特点,可逆反应正逆反应同时进行,反应物不可能完全转化.

练习册系列答案
相关题目
9.已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.
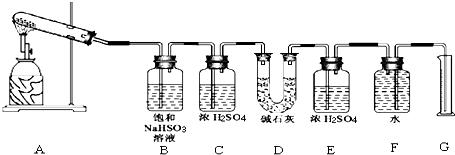
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.

[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
10. 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO═3H++6H2O+(CH2)6N4H+(滴定时,1mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是溶液由无色变为粉红,且保持半分钟不变色.
⑤如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1050mol•L-1则该样品中氮的质量分数为19.6%.
 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+(滴定时,1mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是溶液由无色变为粉红,且保持半分钟不变色.
⑤如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
7.适度饮水有益于健康,但过量饮水使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是( )
| A. | CO2 | B. | NaCl | C. | BaSO4 | D. | 葡萄糖 |
14.下列物质属于含有共价键的离子化合物的是( )
| A. | Na2O2 | B. | H2O | C. | MgCl2 | D. | N2 |
4.下列说法正确的是( )
| A. | 按系统命名法,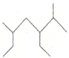 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 | |
| B. | 用Na2C03溶液能区分CH3CO0H、CH3CH2OH、苯和硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加 | |
| D. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 |
11.有关化学反应的说法中,正确的是( )
| A. | 自发反应都是放热反应 | B. | 自发反应都是熵增加的反应 | ||
| C. | 自发反应都是△G<0的反应 | D. | 自发反应都是△G>0的反应 |
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.