题目内容
5.下列说法正确的是( )| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
分析 A.电解质必须是化合物;
B.电离不需要通电;
C.电解质强弱与水溶性无关;
D.硝酸钠为强电解质,在水中完全电离.
解答 解:A.氯气是单质,不是电解质,故A错误;
B.氯化钙在水分子作用下电离出钙离子和氯离子,故B错误;
C.电解质强弱与水溶性无关,取决于电离程度,完全电离的电解质属于强电解质,故C错误;
D.硝酸钠为强电解质,在水中完全电离,电离方程式:NaNO3═Na++NO3-,故D正确;
故选:D.
点评 本题考查了电解质、强电解质的判断,电解质电离方程式的书写,明确相关概念是解题关键,注意电解质的强弱与水溶性无关,取决于电离程度,题目难度不大.

练习册系列答案
相关题目
15.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
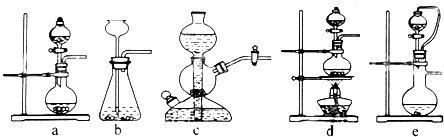
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是ae(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠33.1g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
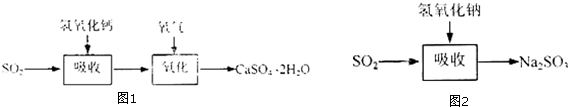
已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是利用SO2是酸性氧化物,可与碱反应.和碱法相比,石灰-石膏法的优点是原料易得,成本低,缺点是亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低.
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是ae(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠33.1g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
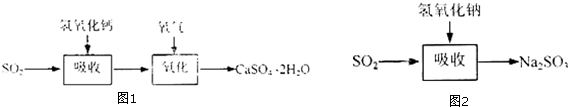
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
16.下列说法正确的是( )
| A. | 相同温度下,硫酸溶液的导电能力应强于醋酸溶液的导电能力 | |
| B. | NaCl在电流作用下电离成Na+和Cl- | |
| C. | CuSO4溶液导电时要伴随化学变化 | |
| D. | CO2水溶液的导电能力较弱,CO2是弱电解质 |
10.下列有关电解质溶液的说法正确的是( )
| A. | SO3溶于水后能导电,故SO3为电解质 | |
| B. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| C. | CaCO3难溶于稀硫酸,也难溶于醋酸 | |
| D. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 |
14.在无色溶液中,下列各组离子可能大量共存的是( )
| A. | OH-、NO3-、HCO3-、Na+ | B. | Na+、SO42-、Mg2+、I- | ||
| C. | NO3-、Cu2+、K+、Cl- | D. | H+、K+、ClO-、Ba2+ |
15. 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
(1)用物质的A表示的反应的平均速率为0.3mol/L•s.
(2)2s时物质A的转化率为30%.
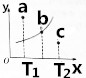
(3)图中的曲线是该反应在不同温度下的平衡曲线,x中表示温度,y轴表示B的转化率,图中有a、b、c三点,
①该反应是吸热(填“吸热”或“放热”)反应;
②C点:v正>v逆(填“>”、“<”或“=”).
(4)一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入A和B,其起始物质的量及A的平衡转化率如下表所示:
①该温度下,乙中反应的平衡常数K为400;
②A的平衡转化率:α2>α1(填“>”、“<”或“=”);
③容器中C的物质的量浓度:甲<丁(填“>”、“<”或“=”).
 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
(2)2s时物质A的转化率为30%.
(3)图中的曲线是该反应在不同温度下的平衡曲线,x中表示温度,y轴表示B的转化率,图中有a、b、c三点,
①该反应是吸热(填“吸热”或“放热”)反应;
②C点:v正>v逆(填“>”、“<”或“=”).
(4)一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入A和B,其起始物质的量及A的平衡转化率如下表所示:
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
②A的平衡转化率:α2>α1(填“>”、“<”或“=”);
③容器中C的物质的量浓度:甲<丁(填“>”、“<”或“=”).
 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇: