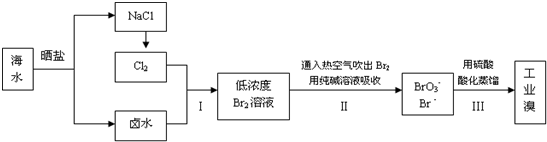
题目内容
10.下列有关电解质溶液的说法正确的是( )| A. | SO3溶于水后能导电,故SO3为电解质 | |
| B. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| C. | CaCO3难溶于稀硫酸,也难溶于醋酸 | |
| D. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 |
分析 A.电解质必须本身能够电离;
B.浓硫酸稀释产生大量的热,水的电离为吸热过程;
C.依据碳酸钙与硫酸、醋酸反应产物性质解答;
D.CH3COONH4促进水的电离.
解答 解:A.三氧化硫溶于水后能导电是因为与水反应生成电解质硫酸,硫酸电离产生自由离子,而三氧化硫本身不能电离,所以是非电解质,故A错误;
B.在蒸馏水中滴加浓H2SO4,浓硫酸稀释产生大量的热,是水的温度升高电离,KW增大,故B错误;
C.CaCO3与稀硫酸反应,生成微溶物硫酸钙附着在石灰石表面,使CaCO3与稀硫酸不能接触,反应停止.所以CaCO3难溶于稀硫酸,CaCO3与醋酸反应,生成的醋酸钙易溶于水,使CaCO3不断反应,所以CaCO3能溶于醋酸,故C错误;
D.CH3COONH4促进水的电离,KCl对水的电离无影响,所以两溶液中水的电离程度不同,故D正确;
故选:D.
点评 本题考查了电解质判断及水的电离平衡移动影响因素,明确电解质概念及化学平衡移动原理是解题关键,注意浓硫酸稀释产生大量的热,题目难度不大.

练习册系列答案
相关题目
1.下列离子方程式书写错误的是( )
| A. | 小苏打与烧碱溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向氯化铝溶液中加入足量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
18.在密闭容器中合成氨反应:N2(g)+3H2(g)?2NH3(g),在下列情况下,不能使反应速度加快的是( )
| A. | 加入氮气 | B. | 扩大容器体积,减小压强 | ||
| C. | 加入适量催化剂 | D. | 适当升高温度 |
5.下列说法正确的是( )
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71 g Cl2含有的氯原子数目为NA | |
| B. | 标准状况下,2.24 L水所含的分子数为0.1 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA |
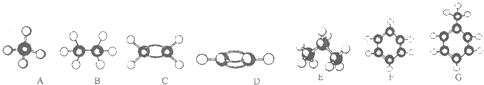
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型. (1)写出由甲苯制备TNT的化学反应方程式
(1)写出由甲苯制备TNT的化学反应方程式 .
. ;Y的结构简式为:
;Y的结构简式为: .
.