题目内容
13.为了使K2S溶液中[K+]/[S2-]的比值变小,可加入的物质是( )①适量的HCl;②适量的NaOH;③适量的KOH;④适量的NaHS.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ②④ |
分析 在硫化钾溶液中电离出钾离子和硫离子,硫离子水解,导致硫离子浓度会减小,要使钾离子和硫离子浓度的比值变小,根据硫离子水解平衡S2-+H2O?HS-+OH-及影响因素进行解答.
解答 解:在硫化钾溶液中电离出钾离子和硫离子,硫离子水解方程式为:S2-+H2O?HS-+OH-,要使钾离子和硫离子浓度比值减小,需使硫离子水解平向逆方向移动即可,
①加入盐酸,会使得化学平衡正向移动,[S2-]减小,则使得比值变大,故错误;
②适量NaOH溶液,平衡向着逆向移动,使得S2-的物质的量增大,而钾离子的物质的量不变,则比值减小,故正确;
③加入适量的氢氧化钾溶液,会使的[K+]增大,使得比值变大,故错误;
④加入适量NaHS,平衡逆向移动,使得硫离子浓度增加,所以比值减小,故正确;
故选D.
点评 本题考查了盐的水解原理及其应用,题目难度不大,注意掌握盐的水解原理,明确影响盐的水解的常见因素,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、H2S、PH3稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2碱性依次增强 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次增大 |
4.抗生素药物“芬必得”的主要成分的结构简式如图所示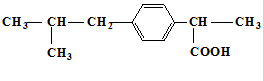 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )
 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
1.下列离子方程式书写错误的是( )
| A. | 小苏打与烧碱溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向氯化铝溶液中加入足量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
18.在密闭容器中合成氨反应:N2(g)+3H2(g)?2NH3(g),在下列情况下,不能使反应速度加快的是( )
| A. | 加入氮气 | B. | 扩大容器体积,减小压强 | ||
| C. | 加入适量催化剂 | D. | 适当升高温度 |
5.下列说法正确的是( )
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71 g Cl2含有的氯原子数目为NA | |
| B. | 标准状况下,2.24 L水所含的分子数为0.1 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA |
