题目内容
17. 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H
(1)判断反应达到平衡状态的依据是cd(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1.
①该反应△H<0(填“>”或“<”).
②实际生产条件控制在250℃、1.3×104kPa左右,选择
此压强的理由是在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失.
(3)图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
分析 (1)a、都是正反应速率;
b、恒容密闭容器,反应前后都是气体,密度始终不变;
c、反应前后化学计量数之和不相等,物质的量不变,达到平衡状态;
d、浓度不变,正逆反应速率相等;
(2)①根据图示,温度升高,CO转化率降低,平衡向逆向移动;
②在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失;
(3)A、C两点温度一样,压强C点大于A点,故反应速率A<C;A、C两点的温度一样,故化学平衡常数不变;状态B到状态A,H2的体积分数增大,使平衡向逆向移动.
解答 解:(1)a、生成CH3OH的速率与消耗CO的速率都是正反应速率,无法判断是否达到平衡状态,故a错误;
b、热情容积固定,气体的体积不变,故气体的密度变化变化,故b错误;
c、反应前后都是气体,化学计量数之和不相等,故混合气体的总物质的量不变,可以判断达到了平衡状态,故c正确;
d、反应物和生成物的浓度不变,生成速率等于消耗速率,正逆反应速率相等,达到了平衡状态,故d正确;
故选cd.
(2)①根据图1,压强相等情况下,升高温度,CO转化率降低,说明反应为放热,<0;
故答案为:<;
②、由于在1.3×104Kpa下,CO转化率已经较高,若再增大压强,CO转化率提高不大,反而造成生产成本增加,得不偿失;
故答案为:在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失;
(3)根据图2,A、C两点温度相同,C点的压强大于A点,故反应速率:A<C;由于温度相同,故A、C的化学平衡常数相等;B点氢气的含量小于A点的,反应放热,若要提高氢气的含量,必须升高温度;
故答案为:<,=,升温.
点评 本题考查了化学平衡状态的判断,通过图示分析,获得合理数据,题量较多,难度稍大.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
| A. | 用稀硝酸洗涤做过银镜反应的试管 | |
| B. | 用电石和饱和食盐水在启普发生器中制备乙炔 | |
| C. | 用苯、稀硝酸和稀硫酸制备硝基苯 | |
| D. | 溴乙烷与氢氧化钠水溶液共煮后,加入硝酸银溶液检验Br- |
| A. | 71 g Cl2含有的氯原子数目为NA | |
| B. | 标准状况下,2.24 L水所含的分子数为0.1 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA |
| A. | +6 | B. | +8 | C. | +7 | D. | +5 |
| A. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L | |
| C. | 0.3mol/L的Na2SO4溶液中含有的Na+和SO42- 的总物质的量为0.9mol | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
:
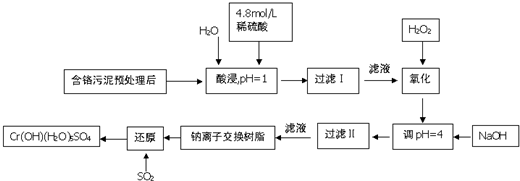
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | 9.3 | 3.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Al(OH)3和Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+(填离子符号).
(5)每生成1mol Cr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是电解氯化钠溶液得到NaOH,从而将Fe3+、Cr3+与OH-反应生成Fe(OH)3和Cr(OH)3沉淀;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
