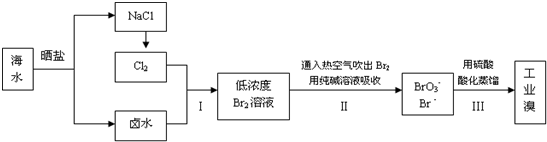
题目内容
14.在无色溶液中,下列各组离子可能大量共存的是( )| A. | OH-、NO3-、HCO3-、Na+ | B. | Na+、SO42-、Mg2+、I- | ||
| C. | NO3-、Cu2+、K+、Cl- | D. | H+、K+、ClO-、Ba2+ |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.OH-、HCO3-结合生成水和碳酸根离子,不能共存,故A错误;
B.该组离子之间不反应,可大量共存,且离子均为无色,故B正确;
C.Cu2+为蓝色,与无色不符,故C错误;
D.H+、ClO-结合生成弱电解质,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存及分析与应用能力的考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
4.抗生素药物“芬必得”的主要成分的结构简式如图所示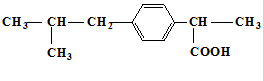 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )
 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
5.下列说法正确的是( )
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71 g Cl2含有的氯原子数目为NA | |
| B. | 标准状况下,2.24 L水所含的分子数为0.1 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA |
9.在强酸性溶液中可发生如下反应:2Mn2++5SOx2-+3H2O═6H++5SO42-+2MnO4-,这个反应可定性地检验Mn2+的存在.在反应中充当氧化剂的SOx2-中S元素的化合价是( )
| A. | +6 | B. | +8 | C. | +7 | D. | +5 |
6.下列有关物质的量浓度的相关说法中正确的是( )
| A. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L | |
| C. | 0.3mol/L的Na2SO4溶液中含有的Na+和SO42- 的总物质的量为0.9mol | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
4.由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置是( )
| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |