题目内容
4.1mol H-H键的键能是436kJ,1mol I-I键的键能是151kJ,1mol H-I键的键能是299kJ,则对反应H2(g)+I2(g)?2HI(g)的说法,不正确的是( )| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:在H2(g)+I2(g)  2HI(g)中,断裂1mol H-H键吸收436kJ,1mol I-I键吸收的键能是151kJ,共吸收的能量为:436kJ+151kJ=587kJ,
2HI(g)中,断裂1mol H-H键吸收436kJ,1mol I-I键吸收的键能是151kJ,共吸收的能量为:436kJ+151kJ=587kJ,
生成2molHI,共形成2molH-I键,共放出的能量为:299kJ×2=598kJ,
吸收的能量少,放出的能量多,该反应为放热反应.
由方程式可知该反应为化合反应和可逆反应.
故选A.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
12.某原电池反应的离子方程式为Zn+Cu2+═Zn2++Cu,关于此原电池,下列说法中正确的是( )
| A. | Cu(NO3)2溶液可作电解质溶液 | |
| B. | 在电解质溶液中,电子由负极流向正极 | |
| C. | 锌极的质量先减小后增大 | |
| D. | 可用镁作正极材料 |
12.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.
(1)O2-的电子式为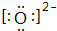 ;
;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键,而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(或者FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
(1)O2-的电子式为
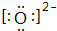 ;
;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键,而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(或者FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
19.NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| B. | 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 | |
| C. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA | |
| D. | 6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
14.下列离子方程式书写正确的是( )
| A. | 铁投入硫酸锌溶液中:Fe+Zn2+═Zn+Fe2+ | |
| B. | 钠投入硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 往饱和Na2CO3溶液中逐滴加入少量稀盐酸:$CO_3^{2-}$+2H+═CO2↑+H2O | |
| D. | 钠投入冷水中:2Na+2H2O═2Na++2OH-+H2↑ |
 反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):
反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质): 主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题: