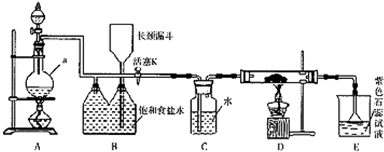
题目内容
19.NA为阿伏伽德罗常数,下列叙述错误的是( )| A. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| B. | 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 | |
| C. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA | |
| D. | 6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
分析 A.乙烯和丁烯最简式是CH2,每个CH2含2个极性键;
B.Mg是+2价的金属,1 mol Mg与足量O2或N2反应均失去2 NA个电子;
C.每一个CO2和O2分子中都含有2个O原子;
D.SO2与氧气生成SO3的反应是可逆反应.
解答 解:A.乙烯和丁烯最简式是CH2,式量是14,42g乙烯和丁烯混合气体含有最简式是3mol,每个CH2含2个极性键,所以含有的极性键数为6 NA,故A正确;
B.Mg是+2价的金属,所以1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子,故B正确;
C.由CO2和O2组成的混合气体中共有NA个分子,由于每一个分子中含有2个O原子,所以1mol的混合气体中的氧原子数为2NA,故C正确;
D.SO2与氧气生成SO3的反应是可逆反应,所以6.4g SO2与足量氧气反应生成SO3,转移电子数小于0.2 NA,故D错误;
故选D.
点评 本题考查阿伏加德罗常数,为高频考点,题目难度不大,注意物质的组成、结构、性质以及可逆反应的特点.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
7.下列有关溶液中粒子浓度的比较中不正确的是( )
| A. | 饱和氯水中滴加0.1mol/L的NaOH溶液:c(H+)+c(Na+ )=2c(ClO-)+c(HClO)+c(OH-) | |
| B. | 向20mL 0.2mol/L 的H2S溶液中逐滴加入0.2mol/L的NaOH溶液30mL,溶液中存在以下关系:c(S2-)+2c(OH-)=c(HS-)+2c(H+)+2c(H2S) | |
| C. | pH相同的①CH3COONa②NaClO 二种溶液的c(Na+):①>② | |
| D. | 常温下,向20mL 0.1mol/L的CH3COONa溶液中逐滴加入0.1mol/L盐酸溶液的pH=7时,c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
10.下列烷烃的系统命名中,正确的是( )
| A. | 2-甲基丙烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,3-三甲基丁烷 |
14.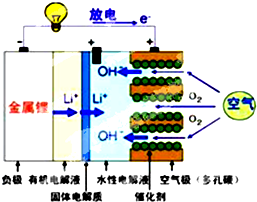 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A. | 负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 | |
| B. | 正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 | |
| C. | 在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 | |
| D. | 锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
4.1mol H-H键的键能是436kJ,1mol I-I键的键能是151kJ,1mol H-I键的键能是299kJ,则对反应H2(g)+I2(g)?2HI(g)的说法,不正确的是( )
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
8.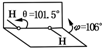 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2是极性分子 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
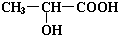 .试回答:
.试回答: +2Na→
+2Na→ +H2↑.
+H2↑.