题目内容
12.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.(1)O2-的电子式为
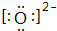 ;
;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键,而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(或者FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2.
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g.请写出该水解反应方程式MgC2+2H2O=Mg(OH)2+C2H2↑.
分析 (1)氧元素的原子序数为8,O2-的最外层电子数为8,用“[]”括起并在右上角注明所带电荷;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,例如ClO2、O3、Cl2等;
(3)由于甲醇分子之间能形成氢键,而乙烷不能;
(4)①氯气具有强氧化性,能氧化亚硫酸钠;
②由于Fe(或者FeCl3)能催化苯与氯气的反应;
③设溶液中氯离子的物质的量为11mol,则次氯酸根离子的物质的量是1mol,根据电子得失守恒可知氯酸根离子的物质的量;
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g,因此该气体的相对分子质量是2.6÷0.1=26,所以该气体是乙炔,因此该化合物是MgC2.
解答 解:(1)氧元素的原子序数为8,O2-的最外层电子数为8,电子式为: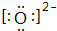 ,
,
故答案为: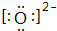 ;
;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,例如ClO2、O3、Cl2等,
故答案为:O3、Cl2;
(3)由于甲醇分子之间能形成氢键,而乙烷不能,CH3OH在常温下为液态,沸点高于乙烷的,
故答案为:甲醇分子之间能形成氢键,而乙烷不能;
(4)①氯气具有强氧化性,能氧化亚硫酸钠,反应离子方程式为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-,
故答案为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-;
②由于Fe(或者FeCl3)能催化苯与氯气的反应,所以若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,
故答案为:Fe(或者FeCl3)能催化苯与氯气的反应;
③设溶液中氯离子的物质的量为11mol,则次氯酸根离子的物质的量是1mol,根据电子得失守恒可知氯酸根离子的物质的量是(11-1)mol÷5=2mol,则c(ClO-):c(ClO3-)=1:2,
故答案为:1:2;
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.6g,因此该气体的相对分子质量是2.6÷0.1=26,所以该气体是乙炔,因此该化合物是MgC2,水解反应方程式为:MgC2+2H2O=Mg(OH)2+C2H2↑,
故答案为:MgC2+2H2O=Mg(OH)2+C2H2↑.
点评 本题考查电子式、氢键、元素和化合物的性质、氧化还原反应计算等知识,属于拼合型题目,是对学生综合能力的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 原子及其简单阴离子的核外电子层数都等于该元素所在的周期数 | |
| B. | 原子最外层电子数都等于其所在的族序数 | |
| C. | 元素周期表从ⅢB到ⅡB族共8个纵行,全都是金属元素 | |
| D. | 同周期表中ⅦA族元素的原子半径较小 |
| A. | 漂白粉、次氯酸溶液和明矾都是混合物 | |
| B. | 不能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 | |
| D. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 |
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |
①
 ②
② ③CH3OH④
③CH3OH④ ⑤
⑤ ⑥
⑥
| A. | ①④⑤ | B. | ④⑥ | C. | ②⑥ | D. | ①②⑥ |
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.