题目内容
3.下列各组离子在溶液中能大量共存的是( )| A. | Fe3+、Cl-、NO3- | B. | K+、HCO3-、OH- | C. | Na+、HCO3-、H+ | D. | NH4+、H+、SO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A选;
B.HCO3-、OH-结合生成水、碳酸根离子,不能共存,故B不选;
C.HCO3-、H+结合生成水和气体,不能共存,故C不选;
D.H+、SO32-结合生成水和气体,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
13.下列元素中,原子M层电子数与K层数相同的有( )
| A. | F | B. | Mg | C. | Al | D. | Si |
14.下列关于铝及其化合物的叙述正确的是( )
| A. | 氢氧化铝可作胃酸的中和剂 | B. | 工业上采用电解熔融氯化铝制铝 | ||
| C. | 铝罐可久盛食醋 | D. | 明矾用作净水剂不涉及化学变化 |
11.CO和CH4的混合气体若恰好在等体积O2中完全燃烧,则原混合气体中CO和CH4的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
18.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,4.48L Cl2溶于水所得氯水中含氯的微粒总数为0.4NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
5.二氧化氯(ClO2)是极易溶于水且不发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水.某小组在实验室中探究ClO2与Na2S的反应.回答下列问题:
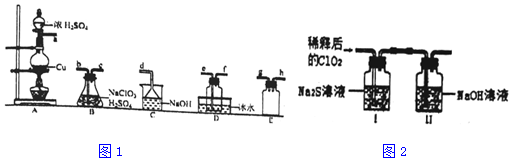
(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
②欲收集干燥的ClO2,选择图1中的装置,其连接顺序为a→g→h→b→c→e→f→d(按气流方向,用小写字母表示)
③装置D的作用是冷凝并收集ClO2.
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
④ClO2与Na2S反应的离子方程式为8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+.

(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
②欲收集干燥的ClO2,选择图1中的装置,其连接顺序为a→g→h→b→c→e→f→d(按气流方向,用小写字母表示)
③装置D的作用是冷凝并收集ClO2.
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42- |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,________ | 有白色沉淀生成 | 有Cl-生成 |
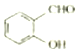 <
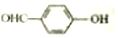
<
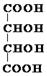 .
.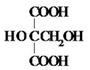 .M的核磁共振氢谱图中有4组吸收峰.
.M的核磁共振氢谱图中有4组吸收峰.