题目内容
7.比较下列各项中的前者和后者,用“>”、“<”、或“=”填空(1)沸点:
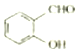 <
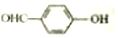
<
(2)在水中的溶解度:CH3CH2OH>CH3(CH3)2CH2OH
(3)酸性:HClO3<HClO4
(4)键长:H-O<H-S
(5)未成对电子数:O<Cr.
分析 (1) 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键;
形成分子间氢键;
(2)饱和一元醇,烃基碳原子数越多,在水中的溶解度越小;
(3)判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;
(4)同一主族元素,元素原子半径随着原子序数增大而增大;
(5)O的核外电子排布式为1s2 2s22p4,p能级包括3个原子轨道,因此未成对电子数为2;Cr的电子排布式为1s22s22p63s23p63d54s1,未成对电子数是6.
解答 解:(1) 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间形成氢键物质的熔沸点增强,所以沸点:
形成分子间氢键,分子间形成氢键物质的熔沸点增强,所以沸点: <
< ,故答案为:<;
,故答案为:<;
(2)饱和一元醇,烃基碳原子数越多,在水中的溶解度越小,所以溶解度CH3CH2OH>CH3(CH3)2CH2OH,故答案为:>;
(3)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:HClO3<HClO4;故答案为:<;
(4)同一主族元素,元素原子半径随着原子序数增大而增大,所以键长:H-O<H-S,
故答案为:<;
(5)O的核外电子排布式为1s2 2s22p4,p能级包括3个原子轨道,因此未成对电子数为2;Cr的电子排布式为1s22s22p63s23p63d54s1,未成对电子数是6,所以未成对电子数:O<Cr,故答案为:<.
点评 本题考查了酸性强弱的比较,题目难度不大,注意判断含氧酸酸性的方法:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强.

练习册系列答案
相关题目
6.下列物质中,不能作为干燥剂的是( )
| A. | 蓝色硫酸铜 | B. | 液体浓硫酸 | C. | 无水氯化钙 | D. | 白色碱石灰 |
3.下列各组离子在溶液中能大量共存的是( )
| A. | Fe3+、Cl-、NO3- | B. | K+、HCO3-、OH- | C. | Na+、HCO3-、H+ | D. | NH4+、H+、SO32- |
16.构成金属晶体的基本微粒是( )
| A. | 分子 | B. | 原子 | ||
| C. | 阳离子与阴离子 | D. | 阳离子与自由电子 |
17.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
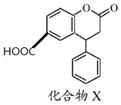

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
 ;
;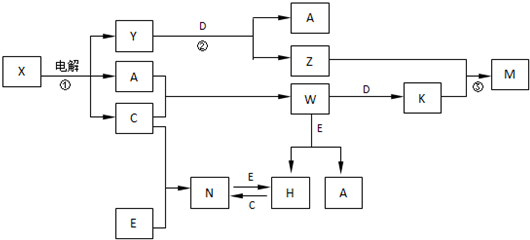
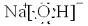 ,构成E单质的元素在周期表中位于第四周期第Ⅷ族.
,构成E单质的元素在周期表中位于第四周期第Ⅷ族.