题目内容
20.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )| A. | 碳酸钙粉末 | B. | 稀硫酸 | C. | 氯化钙溶液 | D. | 二氧化硫水溶液 |
分析 在氯水中存在反应Cl2+H2O?H++Cl-+HClO,若反应使溶液中次氯酸浓度增大,则溶液漂白性会增强,据此分析判断选项.
解答 解:在氯水中存在反应Cl2+H2O?H++Cl-+HClO,若反应氢离子和碳酸根反应 使反应向右进行,使溶液中次氯酸浓度增大,则溶液漂白性会增强,
A.由于酸性HCl>H2CO3>HClO,向溶液中加入碳酸钙粉末反应反应2HCl+CaCO3=CaCl2+CO2↑+H2O,使化学平衡正向进行,导致次氯酸浓度增大,溶液漂白性增强,故A正确;
B.加入稀硫酸使溶液 中氢离子浓度增大平衡逆向进行,次氯酸浓度减小,溶液漂白性减弱,故B错误;
C.加入氯化钙溶液不发生反应,溶液对氯水起到稀释作用,平衡正向进行但次氯酸浓度减小,漂白性减弱,故C错误;
D.加入二氧化硫的水溶液,二氧化硫有还原性,能被氯气氧化,平衡逆向进行,次氯酸浓度减小,漂白性减弱,故D错误;
故选A.
点评 本题考查了氯气、次氯酸、氯水性质的分析,主要是化学平衡影响因素的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
10.基态时,某原子核外被电子占据的轨道共9个,其中有7个轨道已经被电子占满,这种元素是( )
| A. | Si | B. | P | C. | S | D. | Cl |
11.下列图示与对应的叙述不相符合的是( )
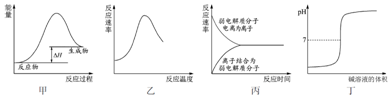

| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
15.下列说法中正确的是( )
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
5.类比推理是化学中常用的思维方法.下列推理正确的是( )
| A. | CO2是直线型分子,推测CS2也是直线型分子 | |
| B. | SiH4的沸点高于CH4,推测H2Se的沸点高于H2S | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
6.下列反应属于吸热反应的是( )
| A. | 氯化铵与消石灰反应 | B. | 酸碱中和反应 | ||
| C. | 铝热反应 | D. | 锌与盐酸反应 |
4.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
下列说法正确的是( )
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
下列说法正确的是( )
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |