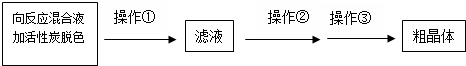
题目内容
6.甲醇汽油是由10%~25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,下表是该反应在不同温度下的化学平衡常数(K):
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是A(填序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2mol H2,发生反应CO(g)+2 H2(g)?CH3OH(g)△H=a kJ/mol.恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;
已知T1<T2,则ω1Dω2(填序号).
A.大于 B.小于 C.等于 D.以上都有可能.
分析 (1)温度升高,K值减小,平衡向左移动,升高温度平衡向吸热方向移动;
(2)开始c(CO)=$\frac{2mol}{2L}$=1mol/L、c(H2)=$\frac{6mol}{2L}$=3mol/L,平衡时c(CO)=0.5mol•L-1,
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L)1 3 0
反应(mol/L)0.5 1 0.5
平衡(mol/L)0.5 2 0.5
先计算化学平衡常数K,再根据K判断温度;
(3)①v(H2)=$\frac{△c}{△t}$;
②反应达到平衡时CO的转化率=$\frac{参加反应的c(CO)}{反应初始c(CO)}$×100%;
③2~4min内的反应速率大于0~2min 内的反应速率,且反应物浓度减少、生成物浓度增加;
(4)如果时间很短,未充分反应,则温度高的反应快;如果充分反应后,温度高的,因为平衡向左移动,CO量较多.
解答 解:(1)温度升高,K值减小,平衡向左移动,升高温度平衡向吸热方向移动,所以负反应吸热,故正反应放热,所以△H<0,即a<0,故答案为:<;
(2)开始c(CO)=$\frac{2mol}{2L}$=1mol/L、c(H2)=$\frac{6mol}{2L}$=3mol/L,平衡时c(CO)=0.5mol•L-1,
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L)1 3 0
反应(mol/L)0.5 1 0.5
平衡(mol/L)0.5 2 0.5
化学平衡常数K=$\frac{0.5}{0.5×{2}^{2}}$=0.25,为310℃的平衡常数,
故答案为:310;
(3)①v(H2)=$\frac{△c}{△t}$=$\frac{1.2-0.6}{2}$mol/(L.min)=0.3mol/(L•min)
故答案为:0.3mol/(L•min);
②反应达到平衡时CO的转化率=$\frac{参加反应的c(CO)}{反应初始c(CO)}$×100%=$\frac{(0.8-0.3)mol/L}{0.8mol/L}$×100%=62.5%,
故答案为:62.5%;
③2~4min内的反应速率大于0~2min 内的反应速率,且反应物浓度减少、生成物浓度增加,所以改变的条件是加入催化剂,
故答案为:A;
(4)如果时间很短,未充分反应,则温度高的反应快,CO量少;如果充分反应后,温度高的,因为平衡向左移动,CO量较多,所以都有可能,故选D.
点评 本题考查化学平衡计算及外界条件对化学平衡移动影响,侧重考查学生分析判断及计算能力,正确分析表中数据的变化及引起变化的原因是解本题关键,难点是(4)判断,很多同学往往不考虑没有充分反应时间段而导致错误判断,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |
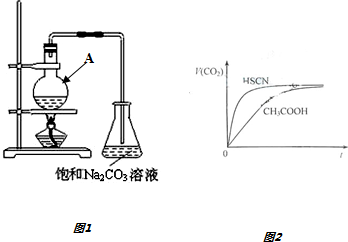
(1)仪器A的名称是圆底烧瓶.往仪器A中加入原料的正确顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸.
(2)在仪器A中生成乙酸乙酯的化学反应方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子(H+ )液体可用作该反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合)
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
(5)常温下,将20mL 0.10mol•L-1 CH3COOH溶液和20mL 10mol•L-1 HSCN溶液分别与20mL 0.10mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图2所示,由图分析:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(6)设计一个简单的实验证明醋酸是弱酸.
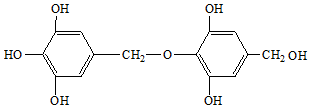 与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )
与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 2 mol |
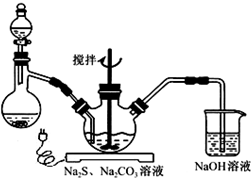 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: