题目内容
下列叙述正确的是( )
| A、FeCl3溶液中加入镁粉有气泡产生 |
| B、Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、向饱和NaCl溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
考点:盐类水解的应用,原电池和电解池的工作原理,氯气的化学性质,二氧化硫的化学性质
专题:元素及其化合物
分析:A.氯化铁是强酸弱碱盐,铁离子水解导致其溶液产生酸性,酸和镁发生置换反应;
B.次氯酸具有强氧化性,二氧化硫能和有色物质反应生成无色物质;
C.铅蓄电池放电时,负极上电极反应式为Pb+SO42--2e-=PbSO4;
D.向饱和NaCl溶液中先通入足量NH3,再通入足量CO2.
B.次氯酸具有强氧化性,二氧化硫能和有色物质反应生成无色物质;
C.铅蓄电池放电时,负极上电极反应式为Pb+SO42--2e-=PbSO4;
D.向饱和NaCl溶液中先通入足量NH3,再通入足量CO2.
解答:
解:A.氯化铁是强酸弱碱盐,铁离子水解导致其溶液产生酸性FeCl3+3H2O?Fe(OH)3+3HCl,镁和稀盐酸反应生成氢气,故A正确;
B.氯气和水反应生成次氯酸,次氯酸具有强氧化性而使品红溶液褪色,二氧化硫能和有色物质反应生成无色物质,所以二者的漂白性不同,故B错误;
C.铅蓄电池放电时,负极上电极反应式为Pb+SO42--2e-=PbSO4↓,所以随着反应的进行,负极质量增加,故C错误;
D.二氧化碳不易溶于饱和氯化钠溶液,氨气极易溶于饱和氯化钠溶液,所以向饱和NaCl溶液中先通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,故D错误;
故选A.
B.氯气和水反应生成次氯酸,次氯酸具有强氧化性而使品红溶液褪色,二氧化硫能和有色物质反应生成无色物质,所以二者的漂白性不同,故B错误;
C.铅蓄电池放电时,负极上电极反应式为Pb+SO42--2e-=PbSO4↓,所以随着反应的进行,负极质量增加,故C错误;
D.二氧化碳不易溶于饱和氯化钠溶液,氨气极易溶于饱和氯化钠溶液,所以向饱和NaCl溶液中先通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,故D错误;
故选A.
点评:本题考查了盐类水解、物质的漂白性、原电池原理等知识点,根据盐的性质、物质漂白原理、原电池原理等知识点来分析解答,注意次氯酸、二氧化硫、臭氧、过氧化钠漂白原理的异同点,会书写铅蓄电池电极反应式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有机化合物中,属于醇的有( )
| A、CH3CH3 |
| B、CH2=CHCl |
| C、CH3CH2OH |
| D、CH3COOCH2CH3 |
下列实验设计及其对应的离子方程式均正确的是( )
A、制备Fe(OH)3胶体的反应:Fe3++3H2O
| ||||
| B、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | ||||
| C、将氯气溶于水:C12+H2O═2H++Cl-+ClO- | ||||
| D、用稀氢氧化钠溶液吸收二氧化氮尾气:2OH-+2NO2═NO3-+NO+H2O |
标准状况下有①6.72LCH4;②3.01×1023个HCl;③13.6gH2S(g);④0.2molNH3(g).下列对四种气体的关系从小到大表示不正确的是( )
| A、体积:④<①<③<② |
| B、氢原子数:②<④<③<① |
| C、质量:①<④<③<② |
| D、密度:①<④<③<② |
在一密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
| A、NO2的消耗速率与NO的生成速率相等 |
| B、容器内NO2的物质的量与NO的物质的量相等 |
| C、NO2和O2的消耗速率之比为2:1 |
| D、单位时间内生成2n molNO.同时生成n molO2 |
以下说法正确的是( )
| A、氢键属于化学键,但比较弱 |
| B、任何物质中都一定含有化学键 |
| C、NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 |
| D、H2O2中既有极性键,又有非极性键 |
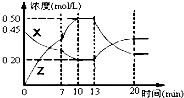 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A、用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L?min) |
| B、化学方程式中a:b=1:3 |
| C、推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D、推测该反应处于化学平衡状态的时间是10min--13min及第20min后 |
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.