题目内容
在一密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
| A、NO2的消耗速率与NO的生成速率相等 |
| B、容器内NO2的物质的量与NO的物质的量相等 |
| C、NO2和O2的消耗速率之比为2:1 |
| D、单位时间内生成2n molNO.同时生成n molO2 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答:
解:A、消耗NO2和生成NO都是正向进行反应,不能表现正逆反应速率相等,故A错误;
B、反应达到平衡时的各物质的物质的量与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故B错误;
C、反应物和生成物消耗速率之比等于其化学计量数之比,说明正逆反应速率相等,故C正确;
D、生成NO和生成氧气,都是正向进行反应,故D错误.
故选:C.
B、反应达到平衡时的各物质的物质的量与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故B错误;
C、反应物和生成物消耗速率之比等于其化学计量数之比,说明正逆反应速率相等,故C正确;
D、生成NO和生成氧气,都是正向进行反应,故D错误.
故选:C.
点评:本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
相关题目
科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
| A、暖冰中水分子是直线型分子 |
| B、暖冰中水分子的各原子均满足8电子稳定结构 |
| C、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
| D、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、SCN-、SO42- | ||
B、
| ||
| C、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | ||
| D、水电离产生的c(H+)=10-12mol?L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A、重水是原子反应堆的导热剂 |
| B、氘(D)原子核内有1个中子 |
| C、H2O与D2O的物理性质不相同 |
| D、1H、D与16O、18O形成的水分子,其相对分子质量不相同的有5种 |
碳酸钠俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
| A、碱 | B、含氧酸盐 |
| C、钠盐 | D、碳酸盐 |
下列叙述正确的是( )
| A、FeCl3溶液中加入镁粉有气泡产生 |
| B、Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、向饱和NaCl溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
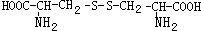
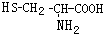 ,则下列说法错误的是
,则下列说法错误的是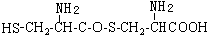
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体. 现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答:
现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答: