题目内容
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.实验一配制一定浓度的醋酸溶液
(1)取冰醋酸配制250mL0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
实验二 探究浓度对醋酸电离程度的影响
测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol?L-1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)已知10-2.73=1.86×10-3,利用此数据可以求得0.2000mol?L-1醋酸溶液的电离度α=
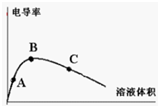
(4)用水稀释冰醋酸,电导率随加入水量的变化如右图所示A、B、C三点的电离度由大到小排列:
实验三 探究
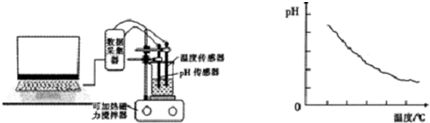
某同学利用传感器技术(如右下图),将20mL,0.1mol/L醋酸溶液放置在可加热磁力搅拌器上,并用pH传感器测量溶液的pH,利用电脑处理实验数据并作图(如下图)
(5)由数据处理结果可以得到的结论是
考点:比较强弱电解质的实验
专题:实验设计题
分析:(1)根据配制一定物质的量浓度的溶液的步骤确定实验仪器;
(2)表中pH值结果读到0.01,则应该使用pH计测量;强电解质完全电离,弱电解质部分电离,醋酸为弱电解质,溶液中部分电离出氢离子;
(3)根据电离度的表达式及题中数据进行计算;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;
(5)根据题中图象数据可知,该实验探究的是温度对醋酸电离程度的影响;根据醋酸的电离为吸热过程得出结论.
(2)表中pH值结果读到0.01,则应该使用pH计测量;强电解质完全电离,弱电解质部分电离,醋酸为弱电解质,溶液中部分电离出氢离子;
(3)根据电离度的表达式及题中数据进行计算;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;
(5)根据题中图象数据可知,该实验探究的是温度对醋酸电离程度的影响;根据醋酸的电离为吸热过程得出结论.
解答:
解:(1)配制250mL 0.2mol/L醋酸溶液步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用量筒量取冰醋酸,把冰醋酸倒入烧杯进行溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要玻璃仪器有玻璃棒、烧杯、胶头滴管、250mL容量瓶、量筒,
故答案为:胶头滴管;250mL容量瓶;
(2)测定的pH结果需要读到0.01,所以应该使用pH进行测定溶液的pH;若醋酸为强酸,则完全电离由于是一元酸,0.0100mol/L的醋酸的PH应为2,已知PH为3.38,说明醋酸没有完全电离是弱酸,
故答案为:pH计;0.0100 mol/L 醋酸的pH大于2(或醋酸稀释10倍时,pH的变化值小于l);
(3)0.2000mol?L-1醋酸溶液中氢离子浓度为:10-2.73mol/L=1.86×10-3mol/L,所以醋酸的电离度为:
×100%=0.93%,
故答案为:0.93%;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以A、B、C三点的电离度由大到小排列为:C>B>A,
故答案为:C>B>A;
实验三:根据图象横坐标可知,本实验是探究温度对醋酸电离度的影响,
故答案为:温度;
(5)根据图象可知,随着温度升高,醋酸溶液的pH逐渐减小,说明升高温度,溶液中氢离子浓度增大,醋酸的电离程度逐渐增大,
故答案为:温度越高,醋酸的电离程度越大.
故答案为:胶头滴管;250mL容量瓶;
(2)测定的pH结果需要读到0.01,所以应该使用pH进行测定溶液的pH;若醋酸为强酸,则完全电离由于是一元酸,0.0100mol/L的醋酸的PH应为2,已知PH为3.38,说明醋酸没有完全电离是弱酸,
故答案为:pH计;0.0100 mol/L 醋酸的pH大于2(或醋酸稀释10倍时,pH的变化值小于l);
(3)0.2000mol?L-1醋酸溶液中氢离子浓度为:10-2.73mol/L=1.86×10-3mol/L,所以醋酸的电离度为:
| 1.86×10-3mol/L |
| 0.2000mol/L |
故答案为:0.93%;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以A、B、C三点的电离度由大到小排列为:C>B>A,
故答案为:C>B>A;
实验三:根据图象横坐标可知,本实验是探究温度对醋酸电离度的影响,
故答案为:温度;
(5)根据图象可知,随着温度升高,醋酸溶液的pH逐渐减小,说明升高温度,溶液中氢离子浓度增大,醋酸的电离程度逐渐增大,
故答案为:温度越高,醋酸的电离程度越大.
点评:本题考查配制溶液所需仪器、弱电解质的电离等知识,题目难度增大,试题题量稍大,注意掌握配制溶液的步骤、所需仪器以及操作的注意事项等问题,明确弱电解质在溶液中部分电离及影响弱电解质电离的因素.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
体积均为aL的NaCl溶液、MgCl2溶液、AlCl3溶液,均能与bL 1mol.L-1AgNO3溶液恰好完全反应.则NaCl、MgCl2、AlCl3的物质的量浓度之比为( )
| A、1:2:3 |
| B、3:2:1 |
| C、6:3:2 |
| D、1:1:1 |
下列叙述正确的是( )
| A、FeCl3溶液中加入镁粉有气泡产生 |
| B、Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、向饱和NaCl溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
| A、该元素是金属元素 |
| B、该元素原子的核电荷数为14 |
| C、该元素原子核外有3个电子层 |
| D、该元素原子不容易得到或者失去最外层电子 |
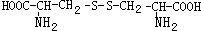
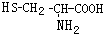 ,则下列说法错误的是
,则下列说法错误的是
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.