题目内容
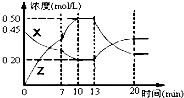 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A、用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L?min) |
| B、化学方程式中a:b=1:3 |
| C、推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D、推测该反应处于化学平衡状态的时间是10min--13min及第20min后 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A.根据v=
计算用X表示0~10min内该反应的平均速率;
B.根据物质的量变化量之比等于化学计量数之比计算;
C.第7min时,X的物质的量浓度瞬间减小,Z的物质的量浓度增大,不可能增大X的浓度;
D.当各组分浓度不再变化,说明达到了平衡状态,据此进行判断.
| △c |
| △t |
B.根据物质的量变化量之比等于化学计量数之比计算;
C.第7min时,X的物质的量浓度瞬间减小,Z的物质的量浓度增大,不可能增大X的浓度;
D.当各组分浓度不再变化,说明达到了平衡状态,据此进行判断.
解答:
解:A.根据图象可知,0~10min内v(X)=
=0.025mol/(L?min),故A错误;
B.物质的量变化量之比等于化学计量数之比,方程式aX(g)+2Y(s)?bZ(g)△H<0中:a:b=(0.45-0.2):(0.50-0)=1:2,故B错误;
C.根据图象,第7min时,单位时间内X、Z的物质的量浓度变化量较大,反应速率增大,且X浓度减小,Z的浓度增大,则可能为升高温度;若增大X的浓度,则X的浓度应该瞬间增大,而图象中X的浓度瞬间减小,故不是增大X浓度,故C错误;
D.10min--13min及第20min后,图象中X和Z的物质的量浓度不再变化,说明该时间段内达到了平衡状态,故D正确.
故选D.
| ||
| 10min |
B.物质的量变化量之比等于化学计量数之比,方程式aX(g)+2Y(s)?bZ(g)△H<0中:a:b=(0.45-0.2):(0.50-0)=1:2,故B错误;
C.根据图象,第7min时,单位时间内X、Z的物质的量浓度变化量较大,反应速率增大,且X浓度减小,Z的浓度增大,则可能为升高温度;若增大X的浓度,则X的浓度应该瞬间增大,而图象中X的浓度瞬间减小,故不是增大X浓度,故C错误;
D.10min--13min及第20min后,图象中X和Z的物质的量浓度不再变化,说明该时间段内达到了平衡状态,故D正确.
故选D.
点评:本题考查了化学平衡的判断、化学反应速率的计算,题目难度中等,注意明确图象曲线变化的分析方法,把握外界条件对平衡移动的影响及化学反应速率的计算方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在浓硫酸作用下,苯与浓硝酸发生如下反应: ,该反应的反应类型是( )
,该反应的反应类型是( )
 ,该反应的反应类型是( )
,该反应的反应类型是( )| A、取代反应 | B、加成反应 |
| C、加聚反应 | D、置换反应 |
重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A、重水是原子反应堆的导热剂 |
| B、氘(D)原子核内有1个中子 |
| C、H2O与D2O的物理性质不相同 |
| D、1H、D与16O、18O形成的水分子,其相对分子质量不相同的有5种 |
下列叙述正确的是( )
| A、FeCl3溶液中加入镁粉有气泡产生 |
| B、Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、向饱和NaCl溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
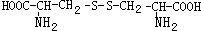
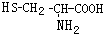 ,则下列说法错误的是
,则下列说法错误的是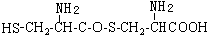
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.