题目内容
3.有BaCl2和KCl的混合溶液VL,将它分成五等份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液使Cl-完全沉淀.反应中消耗mmol H2SO4、nmol AgNO3.据此得知原混合溶液中的K+的物质的量浓度为( )| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
分析 由BaCl2和稀硫酸反应可计算Ba2+离子的物质的量,利用KCl和AgNO3溶液反应计算出Cl-离子的物质的量,由混合液呈电中性可计算出钾离子的物质的量,并注意均分成两份及计算原混合溶液中的c(K+)来解答即可.
解答 解:由Ba2++SO42-═BaSO4↓可知,消耗m mol的H2SO4,则Ba2+离子的物质的量mmol,
由Cl-+Ag+═AgCl↓可知,消耗n mol的AgNO3,则Cl-离子的物质的量为nmol,
设每份中的钾离子的物质的量为x,BaCl2和KCl的混合溶液不显电性,
则x=(n-2m)mol,则原溶液中的钾离子为(n-2m)mol×5=(5n-10m)mol,
c(K+)=$\frac{5n-10m}{V}$mol/L,
故选D.
点评 本题考查离子反应方程式的计算,为高频考点,明确离子之间的量的关系即可解答,利用溶液不显电性来计算钠离子的物质的量是解答的关键,并注意五等份的关系,题目难度不大.

练习册系列答案
相关题目
13.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒,化学性质也相同 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{37}^{17}$Cl得电子能力相同 |
14.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同质量的烃,完全燃烧时,含氢元素质量分数越高的烃,消耗O2量越多 | |
| C. | 常温下分子中氢原子数为4的气态烃,与足量O2完全燃烧时,反应前后气体总体积不变 | |
| D. | 烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积 |
11.下列化学技术与其试图解决的问题不对应的是( )
| A. | 某沿海城市技术开发公司研制的海水淡化膜--资源问题 | |
| B. | 用石灰法进行工业废气脱硫--污染问题 | |
| C. | 研制用纯净的二氧化硅做光导纤维--能源问题 | |
| D. | 中科院研制的新型钛合金用于航空航天--材料问题 |
18.下列反应的有关方程式书写正确的是( )
| A. | 碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 氢氟酸腐蚀玻璃:SiO2+4HF=SiF4↑+2H2O | |
| C. | 硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2O |
1.下表所列实验设计及操作,其现象足以说明结论的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向某种化学肥料中加入熟石灰混合、研磨 | 没有氨味 | 该化学肥料一定不是氮肥 |
| B | 点燃某种纤维材料 | 无烧焦羽毛的气味 | 该纤维一定是合成纤维 |
| C | 向一未知溶液中加入稀盐酸 | 有无色气泡产生 | 该溶液中一定含有CO32- |
| D | 向一未知溶液中先滴加足量稀盐酸,再滴加BaC12溶液 | 先无现象,后产生白色沉淀 | 原溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 只要是有气体参加或生成的化学反应,化学平衡都会受压强的影响 | |
| B. | 增大压强可以使气体分子数增多的可逆反应的正反应速率减小,逆反应速率增大,平衡逆向移动 | |
| C. | 减小压强可以使气体分子数减少的反应逆向移动,同时使正逆反应速率都减小 | |
| D. | 压强对反应前后气体分子数不变的反应的化学平衡和反应速率都没有影响 |
6.不用其他试剂无法鉴别的一组溶液是( )
| A. | 氯化铁溶液和氯化铜溶液 | B. | 硫酸钠溶液和氯化钠溶液 | ||
| C. | 氯化铝溶液和氢氧化钠溶液 | D. | 硫酸氢钠溶液和碳酸钠溶液 |
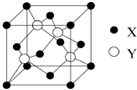 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.