题目内容
13.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒,化学性质也相同 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{37}^{17}$Cl得电子能力相同 |
分析 A、同周期元素最高价含氧酸的酸性随核电荷数的增加而增强;
B、比如钾离子和氯离子,它们的电子排布是相同的,但两者的化学性质不同;
C、氢原子无中子;
D、同位素化学性质相似.
解答 解:A、同周期元素最高价含氧酸的酸性随核电荷数的增加而增强,而不是含氧酸,故A错误;
B、比如钾离子和氯离子,它们的电子排布是相同的,但两者的化学性质不同,故B错误;
C、氢原子无中子,所以并不是所有原子的原子核都由质子和中子构成,故C错误;
D、同位素化学性质相似,所以两者得电子能力相同,故D正确;
故选D.
点评 本题考查元素周期律、原子的构成微粒和同位素的化学性质,学生成要清楚非金属性越强最高价氧化物对应水化物的酸性越强,比较容易.

练习册系列答案
相关题目
3.下列各组数据中,前者刚好是后者两倍的是( )
| A. | 2 mol水的摩尔质量和1 mol水的摩尔质量 | |
| B. | 1 mol/L氯化钙溶液中n(Cl-)和2 mol/L氯化钾溶液中n(Cl-) | |
| C. | 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 | |
| D. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
1.若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所发生的反应类型及耗用氯气的总的物质的量是(设乙烯为1mol,反应产物中的有机物只有四氯乙烷)( )
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
8.钾的金属活动性比钠强,根本原因( )
| A. | 钾的密度比钠小 | B. | 钾的熔点比钠低 | ||
| C. | 钾原子比钠原子多一个电子层 | D. | 加热时钾比钠更易汽化 |
5.为证明化学反应有一定的限度,进行如下探究活动:I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)Ⅱ.继续加入2ml CCl4振荡.Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
ⅱ.写出实验操作“步骤一”中反应的离子方程式为4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓..
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
2.下列文字表述与反应方程式对应,且正确的是( )
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: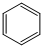 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
3.有BaCl2和KCl的混合溶液VL,将它分成五等份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液使Cl-完全沉淀.反应中消耗mmol H2SO4、nmol AgNO3.据此得知原混合溶液中的K+的物质的量浓度为( )
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |