题目内容
6.不用其他试剂无法鉴别的一组溶液是( )| A. | 氯化铁溶液和氯化铜溶液 | B. | 硫酸钠溶液和氯化钠溶液 | ||
| C. | 氯化铝溶液和氢氧化钠溶液 | D. | 硫酸氢钠溶液和碳酸钠溶液 |
分析 A.溶液颜色不同;
B.两种溶液无色,相互滴加不反应;
C.滴加顺序不同,反应的现象不同;
D.滴加顺序不同,反应的现象不同.
解答 解:A.氯化铁溶液为黄色,氯化铜溶液为蓝色,颜色不同,不用其他试剂就可直接鉴别,故A不选;
B.硫酸钠溶液和氯化钠溶液都呈无色,相互滴加不反应,应用硝酸钡溶液鉴别,故B选;
C.将氯化铝溶液滴加到氢氧化钠溶液中,先无沉淀生成,当氯化铝滴加到一定程度时才有沉淀,但把氢氧化钠溶液滴加到氯化铝溶液中,立即产生沉淀,当氢氧化钠过量时沉淀溶解,滴加顺序不同,反应的现象不同,用其他试剂就可鉴别,故C不选;
D.将硫酸氢钠溶液滴加到碳酸钠溶液中,先无气体生成,当滴加硫酸氢钠溶液一定量时开始生成气体,但把碳酸钠溶液滴加到硫酸氢钠溶液中立即生成气体,滴加顺序不同,现象不同,可鉴别,故D不选;
故选B.
点评 本题考查物质的检验、鉴别,为高频考点,侧重于学生的分析、实验能力的考查,题目难度不大,注意把握物质的性质为解答该类题目的关键.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
3.有BaCl2和KCl的混合溶液VL,将它分成五等份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液使Cl-完全沉淀.反应中消耗mmol H2SO4、nmol AgNO3.据此得知原混合溶液中的K+的物质的量浓度为( )
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
14.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝; F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
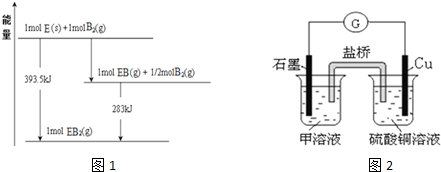
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为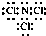 .
.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为
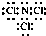 .
.
1.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 伴随能量变化的物质变化都是化学变化 |
18.随着卤素原子核电荷数的递增,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
15.化学与生产、生活息息相关,下列有关说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
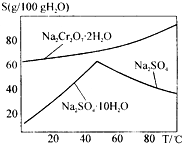 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)