题目内容
8. 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.(1)①在元素周期表中,元素X位于ds区,元素Y位于第三周期第ⅦA族.
②Z所在周期中,第一电离能最大的元素是氖(填元素名称).
③X+的核外电子排布式为1s22s22p63s23p63d10.
④Y和W两元素最高价氧化物对应的水化物酸性较强的是HClO4(填化学式).
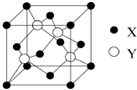
(2)X与Y所形成化合物晶体的晶胞如图所示.在1个晶胞中,X离子的数目为4;该化合物的化学式为CuCl.
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基.
②稳定性:H2Z>H2W(填“>”、“<”或“=”),其主要原因是H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长).
分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,以此解答该题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,
(1)①元素Y为Cl,Cl有3个电子层,最外层7个电子,故处于周期表中第三周期第ⅦA族,元素X为Cu,处于周期表中ds区,故答案为:ds; 三;ⅦA;
②O所在周期为第二周期,其中第一电离能最大的元素是氖,故答案为:氖;
③X为Cu,Cu+的核外电子排布式为:1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
④Cl和S两元素所形成的最高价氧化物对应的水化物分别为H2SO4和HClO4,元素的非金属性越强,其最高价氧化物水化物的酸性越强,由于非金属性Cl>S,故酸性较强的是HClO4,故答案为:HClO4;
(2)Cu与Cl所形成化合物晶体的晶胞如图所示,1个晶胞中Cu为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cl为:4,故此晶胞中Cu与Cl的个数比为1:1,故化学式为:
故答案为:4; CuCl;
(3)①在乙醇中的溶解度:O的氢化物(H2O)大于H2S,其主要原因是:水分子与乙醇分子间能形成氢键,且水分子和乙醇分子中均有羟基,结构相似,
故答案为:水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基;
②由于O原子的比较小于S原子,故H2O分子内H-O的键能大于H2S分子内H-S的键能,或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长,
故答案为:>;H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长)
点评 本题主要考查的是元素的推断以及元素周期律的应用,为高考常见题型,侧重于学生的分析能力和计算能力的考查,涉及元素位置推断、离子核外电子排布式书写、化学反应方程式书写等,平时学习应注意总结归纳.

 阅读快车系列答案
阅读快车系列答案(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
| A. | CaCl2 | B. | KOH | C. | NH3•H2O | D. | H2SO4 |
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
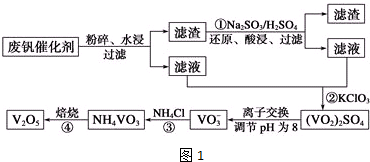
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)图2中所示滤液中含钒的主要成分为VOSO4(写化学式).有学者建议将滤液进行如下处理后再用KClO3氧化
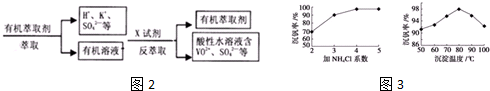
图2中的萃取与反萃取的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂).
RSO4(水层)+2HA(有机层)?RA2(有机层)+H2SO4(水层),上图中的X试剂为硫酸;这种萃取与反萃取过程有别于用CCl4萃取碘水中的碘,二者的相同点是有机层与水溶液不相溶而分层,不同点是这种萃取与反萃取过程利用平衡移动发生了化学反应,而用CCl4萃取碘水中的碘利用了相似相溶原理是物理溶解
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图3判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O=□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
| 实验编号 | a中试剂 | b中试剂 | 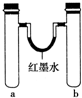 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
(1)实验1:同时加入试剂,反应开始可观察到U形管中液面b(填字母,下同),反应结束静置一段时间,最终U形管中液面c.
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后,U形管中液面出现左低右高,则b管中发生反应的氧化剂是O2(填化学式).
(3)实验3:一段时间后,红棕色气体在b(填“a”或“b”)管液面上方出现,简述另外一试管未出现任何现象的原因:铝在浓硝酸中发生钝化.在其他条件不变的情况下,若将a、b试管中浓硝酸同时改为3mLcd(填编号),即可观察到试管中产生无色的气体,且位置与上述是相反的.
a.无水乙醇 b.浓硫酸 c.稀硫酸 d.烧碱溶液
(4)实验4:一段时间后,U形管中的液面情况是左高右低(用文字简述);写出a试管中发生还原反应的电极反应式:O2+2H2O+4e-═4OH-.
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |