题目内容
5.下列说法正确的是( )| A. | 只要是有气体参加或生成的化学反应,化学平衡都会受压强的影响 | |
| B. | 增大压强可以使气体分子数增多的可逆反应的正反应速率减小,逆反应速率增大,平衡逆向移动 | |
| C. | 减小压强可以使气体分子数减少的反应逆向移动,同时使正逆反应速率都减小 | |
| D. | 压强对反应前后气体分子数不变的反应的化学平衡和反应速率都没有影响 |
分析 A.如反应在溶液中进行,则不受压强影响;
B.增大压强,正逆反应速率都增大;
C.减小压强,正逆反应速率都减小,平衡向体积增大的方向移动;
D.改变压强,气体的反应速率改变.
解答 解:A.如反应在溶液中进行,则不受压强影响,如稀硫酸与活泼金属的反应,故A错误;
B.增大压强,正逆反应速率都增大,平衡向体积减小的方向移动,故B错误;
C.减小压强,正逆反应速率都减小,平衡向体积增大的方向移动,故C正确;
D.改变压强,气体的反应速率改变,反应前后气体分子数不变的反应,正逆反应速率改变相等,平衡不移动,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意外界条件对化学反应速率的影响本质,难度不大.

练习册系列答案
相关题目
2.下列文字表述与反应方程式对应,且正确的是( )
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: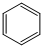 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
3.有BaCl2和KCl的混合溶液VL,将它分成五等份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液使Cl-完全沉淀.反应中消耗mmol H2SO4、nmol AgNO3.据此得知原混合溶液中的K+的物质的量浓度为( )
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
13.碳纳米管是由石墨的一层网状结构卷曲成的单层或多层的管状结构,是继C60发现以后的又一种热点材料,下列叙述不正确的是( )
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
20.某化学小组用如图装置做兴趣实验(具支试管中存有少量空气).
完成下列填空:
(1)实验1:同时加入试剂,反应开始可观察到U形管中液面b(填字母,下同),反应结束静置一段时间,最终U形管中液面c.
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后,U形管中液面出现左低右高,则b管中发生反应的氧化剂是O2(填化学式).
(3)实验3:一段时间后,红棕色气体在b(填“a”或“b”)管液面上方出现,简述另外一试管未出现任何现象的原因:铝在浓硝酸中发生钝化.在其他条件不变的情况下,若将a、b试管中浓硝酸同时改为3mLcd(填编号),即可观察到试管中产生无色的气体,且位置与上述是相反的.
a.无水乙醇 b.浓硫酸 c.稀硫酸 d.烧碱溶液
(4)实验4:一段时间后,U形管中的液面情况是左高右低(用文字简述);写出a试管中发生还原反应的电极反应式:O2+2H2O+4e-═4OH-.
| 实验编号 | a中试剂 | b中试剂 | 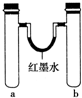 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
(1)实验1:同时加入试剂,反应开始可观察到U形管中液面b(填字母,下同),反应结束静置一段时间,最终U形管中液面c.
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后,U形管中液面出现左低右高,则b管中发生反应的氧化剂是O2(填化学式).
(3)实验3:一段时间后,红棕色气体在b(填“a”或“b”)管液面上方出现,简述另外一试管未出现任何现象的原因:铝在浓硝酸中发生钝化.在其他条件不变的情况下,若将a、b试管中浓硝酸同时改为3mLcd(填编号),即可观察到试管中产生无色的气体,且位置与上述是相反的.
a.无水乙醇 b.浓硫酸 c.稀硫酸 d.烧碱溶液
(4)实验4:一段时间后,U形管中的液面情况是左高右低(用文字简述);写出a试管中发生还原反应的电极反应式:O2+2H2O+4e-═4OH-.
14.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝; F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 .
.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为
 .
.
15.化学与生产、生活息息相关,下列有关说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
