题目内容
14. 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作负极 | B. | 总反应为Ag++Cl-=AgCl | ||
| C. | 正极反应为Ag-e-=Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
分析 该装置是原电池,两电极质量均增大,则左池中银失电子发生氧化反应为负极,产生的银离子与溶液中的氯离子结合成沉淀氯化银,电极反应为Ag-e-+Cl-=AgCl,右池中银作正极,银离子在正极上得电子发生还原反应,电极反应为Ag++e-=Ag,据此解答.
解答 解:A.右池中银作正极,银离子在正极上得电子析出银,质量增大,故A错误;
B.负极反应为Ag-e-+Cl-=AgCl,正极反应为Ag++e-=Ag,则电池总反应为Ag++Cl-═AgCl↓,故B正确;
C.正极银离子得电子发生还原反应,电极反应为Ag++e-=Ag,故C错误;
D.原电池工作时,阴离子向负极移动,则盐桥中的NO3-向左池移动,故D错误;
故选B.
点评 本题考查原电池工作原理,侧重考查学生的分析能力、灵活运用的能力,结合题中信息判断正负极是解题的关键,题目新颖,难度中等.

练习册系列答案
相关题目
4.有机物M的结构简式如图: .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )
 .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 1mol M与烧碱溶液反应时最多消耗2molNaOH | |
| B. | M不能使酸性KMnO4溶液褪色,但能发生取代反应 | |
| C. | M的分子式为C8H14O3 | |
| D. | M可通过加聚反应生成高分子化合物 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 80℃时,1L pH=1的硫酸溶液中,含有的OH-数目为10-13NA | |
| B. | 含0.1mol NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| C. | C3H8分子中的2个H原子分别被1个-NH3和1个-OH取代,1mol此有机物所含共同电子对数目为13NA | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
9.下列有关离子大量共存或离子方程式书写正确的是( )
| A. | c(I-)=0.1mol/L 的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 常温下,通入SO2气体的溶液中:Al3+、Ca2+、MnO4-、Cl- | |
| C. | 控制pH为9-10,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH- | |
| D. | 向含有Ba2+、Cl-、HCO3-的离子组中加入少量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
19.X、Y、Z、W、Q是短周期主族元素,其中X原子最外层电子数是内层电子数的3倍;X与Z同主族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Z与Q形成化合物的电子式为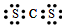 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
6.离子甲与微粒乙在溶液中的转化关系如图所示,则离子甲不可能是( )

| A. | HCO3- | B. | NH4+ | C. | A13+ | D. | Mg2+ |
2.已知反应:
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
| A. | △H1+△H2=△H3 | B. | △H1-△H2=△H3 | C. | △H1+2△H2=△H3 | D. | △H1-2△H2=△H3 |
3.常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)( )
| A. | 溶液的pH值:①>③>② | |
| B. | 水电离出的c(OH-):③>①=② | |
| C. | ①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L | |
| D. | ②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
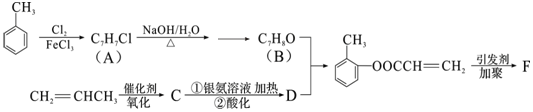
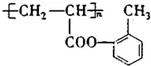
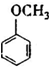 (填结构简式).
(填结构简式).