题目内容
4.有机物M的结构简式如图: .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 1mol M与烧碱溶液反应时最多消耗2molNaOH | |
| B. | M不能使酸性KMnO4溶液褪色,但能发生取代反应 | |
| C. | M的分子式为C8H14O3 | |
| D. | M可通过加聚反应生成高分子化合物 |
分析 有机物含有羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和消去反应,以此解答该题.
解答 解:A.只有羧基与氢氧化钠发生中和反应,则1mol M与烧碱溶液反应时最多消耗1molNaOH,故A错误;
B.含有羟基,可被高锰酸钾氧化,故B错误;
C.由结构简式可知M的分子式为C8H14O3,故C正确;
D.不含碳碳双键,不能发生加聚反应,含有羧基、羟基,可发生缩聚反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意羧酸、醇的性质,题目难度不大.

练习册系列答案
相关题目
14.氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
该反应平衡常数K的表达式为$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;温度升高,K值减小(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=1.875×10-4mol/(L•s);若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是增大压强.
(2)工业合成氨的反应温度选择500℃左右的原因是催化剂在500℃左右具有最佳活性.
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是bc.
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是c(Cl-)>(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液的导电能力几乎不变(选填“变大”、“变小”、“几乎不变”).
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)工业合成氨的反应温度选择500℃左右的原因是催化剂在500℃左右具有最佳活性.
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是bc.
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是c(Cl-)>(NH4+)>c(H+)>c(OH-);在通入NH3的过程中溶液的导电能力几乎不变(选填“变大”、“变小”、“几乎不变”).
15.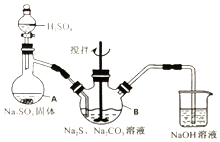 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
…
(1)写出仪器A的名称蒸馏烧瓶.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3.
(4)从上述生成物混合液中获得较高产率Na2S2O3•5H2O的步骤为:
向反应混合液加活性炭脱色$\stackrel{操作①}{→}$滤液$\stackrel{操作②}{→}$$→_{③}^{操作}$粗晶体
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是为了防止晶体在漏斗中大量析出导致产率降低;操作②是蒸发浓缩,冷却结晶;操作①是抽滤、洗涤、干燥.
(5)测定产品纯度
取6.00g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为00.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-.相关数据记录如表所示.
滴定时,达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色.产品的纯度为82.67%.
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
…
(1)写出仪器A的名称蒸馏烧瓶.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因S2O32-+2H+=S↓+SO2↑+H2O.
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3.
(4)从上述生成物混合液中获得较高产率Na2S2O3•5H2O的步骤为:
向反应混合液加活性炭脱色$\stackrel{操作①}{→}$滤液$\stackrel{操作②}{→}$$→_{③}^{操作}$粗晶体
为减少产品的损失,操作①为趁热过滤,“趁热”的原因是为了防止晶体在漏斗中大量析出导致产率降低;操作②是蒸发浓缩,冷却结晶;操作①是抽滤、洗涤、干燥.
(5)测定产品纯度
取6.00g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为00.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-.相关数据记录如表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
12.某有机物Q的结构简式如图,下列有关Q的说法正确的是( )


| A. | 分子式为C14H25O6NBr | |
| B. | 该分子中含有两个手性碳原子 | |
| C. | 不能使酸性高锰酸钾溶液褪色 | |
| D. | Q在一定条件下与氢氧化钠溶液反应,1molQ最多消耗3molNaOH |
19.仪器:①容量瓶、②长颈漏斗、③分液漏斗、④滴定管,使用前必须要检查是否漏液的是( )
| A. | 全部 | B. | ①③④ | C. | 只有③和④ | D. | 只有④ |
9.下列所示装置正确且能完成相关实验的是( )
| A. |  所示装且制取Fe(OH)2 | |
| B. |  所示装置制取SO2 | |
| C. |  所示装置制取O2 | |
| D. |  所示装置比较Cl、C、Si的非金属性强弱 |
16.青铜是我国最早使用的合金.下列关于青铜性质的说法不正确的是( )
| A. | 硬度比纯铜小 | B. | 能够导电 | C. | 熔点比纯铜低 | D. | 能够导热 |
13.有四种短周期的主族元素X、Y、Z、W.X的一种原子常用于鉴定文物的年代,Y是地壳中含量最多的金属元素,W的原子核外某两层电子数目之比为4:3,X和Z同族.下列说法中正确的是( )
| A. | 简单离子半径:Y>W | |
| B. | 上述四种元素的单质中只有2种能导电 | |
| C. | X与Z两者的最高价氧化物的组成和结构相似 | |
| D. | 在加热条件下,Y的单质可溶于W的最高价含氧酸的浓溶液中 |
14. 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作负极 | B. | 总反应为Ag++Cl-=AgCl | ||
| C. | 正极反应为Ag-e-=Ag+ | D. | 盐桥中的NO3-向右池方向移动 |