题目内容
9.下列有关离子大量共存或离子方程式书写正确的是( )| A. | c(I-)=0.1mol/L 的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 常温下,通入SO2气体的溶液中:Al3+、Ca2+、MnO4-、Cl- | |
| C. | 控制pH为9-10,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH- | |
| D. | 向含有Ba2+、Cl-、HCO3-的离子组中加入少量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
分析 A.I-与ClO-发生氧化还原反应;
B.SO2与MnO4-发生氧化还原反应;
C.pH为9-10,为弱碱性溶液,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体,生成二氧化碳和氮气;
D.可生成碳酸钡沉淀.
解答 解:A.I-具有还原性,与具有氧化性的ClO-发生氧化还原反应,不能大量共存,故A错误;
B.SO2具有还原性,与具有氧化性的MnO4-发生氧化还原反应,不能大量共存,故B错误;
C.pH为9-10,为弱碱性溶液,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体,生成二氧化碳和氮气,方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故C正确;
D.含有Ba2+,可生成碳酸钡沉淀,反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O,故D错误.
故选C.
点评 本题综合考查离子反应,为高频考点,注意把握离子的性质以及反应类型的判断,把握离子方程式的书写方法,难度不大.

练习册系列答案
相关题目
19.仪器:①容量瓶、②长颈漏斗、③分液漏斗、④滴定管,使用前必须要检查是否漏液的是( )
| A. | 全部 | B. | ①③④ | C. | 只有③和④ | D. | 只有④ |
20.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已变质 |
| B | 在KI溶液中滴加少量氯水,再加入CCl4,充分震荡. | 液体分层,下层溶液呈紫红色. | 氯的非金属性比碘强 |
| C | 炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中 | 有白色沉淀产生 | 有SO2和CO2产生 |
| D | 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液 | 先生成白色沉淀,后生成黄色沉淀 | 溶解度:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
4.某化合物的化学式为NH5,其电子式为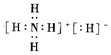 下列有关说法正确的是( )
下列有关说法正确的是( )
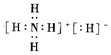 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 该化合物中氢元素的化合价均为+1价 | |
| B. | 该化合物中只有N原子最外层达到稀有气体的稳定结构 | |
| C. | 该化合物中含有$\stackrel{-1}{H}$与$\stackrel{+1}{H}$,二者互为同位素 | |
| D. | 该化合物中既含有共价键,又含有离子键 |
14.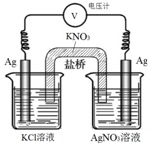 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
 一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测量电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作负极 | B. | 总反应为Ag++Cl-=AgCl | ||
| C. | 正极反应为Ag-e-=Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
1.下列关于有机物的叙述正确的是( )
| A. | 聚乙烯塑料中含有大量碳碳双键,容易老化 | |
| B. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 甲苯苯环上的一个氢原子被一C3H6Cl取代,形成的同分异构体有9种 | |
| D. | CH2═CHCH2OH能发生加成反应、取代反应、氧化反应 |
18.下列试剂中,可以鉴别二氧化碳和二氧化硫的是( )
| A. | 澄清石灰水 | B. | 品红溶液 | ||
| C. | 湿润的蓝色石蕊试纸 | D. | 硝酸银溶液 |
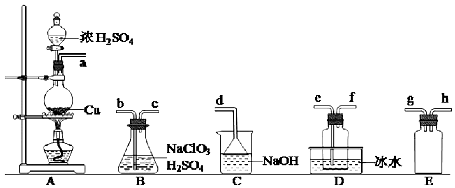
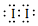 .
.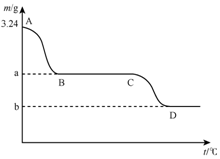 取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:
取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题: