题目内容
7.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X元素原子的价电子的轨道表示式为
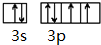 ,该元素的符号是S.
,该元素的符号是S.(2)Q元素原子基态时的电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6.
(3)化合物XZ2与YZ2的空间构型分别是V形和直线形,相同条件下两者在水中的溶解度较大的是SO2(写分子式),理由是二氧化硫和水是极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水.
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(5)比较X的氢化物与同族第二、四周期元素所形成的氢化物的稳定性、沸点高低,并说明理由元素的非金属性越强,其氢化物的稳定性越强,非金属性O>S>Se,所以稳定性H2O>H2S>H2Se;氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,水中含有氢键,所以熔沸点H2O>H2Se>H2S.
分析 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,则X为S元素;
Y原子核外的L层电子数是K层的两倍,则Y为C元素;
Z是地壳内含量(质量分数)最高的元素,则Z是O元素;
Q的核电荷数是X与Z的核电荷数之和,则Q是Cr元素;
E在元素周期表的各元素中电负性最大,则E为F元素;
(1)X为S元素,X元素原子的价电子为其3s、3p电子;
(2)Q为Cr元素,其原子核外有24个电子,根据构造原理书写Q元素原子基态时的电子排布式,在形成化合物时它的最高化合价为+6价;
(3)根据价层电子对互斥理论判断分子晶体空间构型;非极性分子的溶质易溶于非极性分子的溶剂;
(4)E的氢化物为HF,HF分子之间易形成氢键、HF和水分子之间易形成氢键、水分子之间易形成氢键;
(5)元素的非金属性越强,其氢化物的稳定性越强,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高.
解答 解:X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,则X为S元素;
Y原子核外的L层电子数是K层的两倍,则Y为C元素;
Z是地壳内含量(质量分数)最高的元素,则Z是O元素;
Q的核电荷数是X与Z的核电荷数之和,则Q是Cr元素;
E在元素周期表的各元素中电负性最大,则E为F元素;
(1)X为S元素,X元素原子的价电子为其3s、3p电子,其价电子轨道表示式为 ,故答案为:
,故答案为: ;S;
;S;
(2)Q为Cr元素,其原子核外有24个电子,根据构造原理书写Q元素原子基态时的电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6价,
故答案为:1s22s22p63s23p63d54s1;+6;
(3)化合物SO2与CO2中S、C原子价层电子对个数分别是3、2,且二氧化硫分子中含有1个孤电子对、二氧化碳分子中C原子不含孤电子对,则二者空间构型分别是V形和直线形;非极性分子的溶质易溶于非极性分子的溶剂,二氧化硫和水是极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水,
故答案为:V形;直线形;SO2;二氧化硫和水是极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水;
(4)HF的水溶液中,F的电负性较大,可与另一分子的HF或水中的H形成氢键,可表示为H-F…H,氧原子和氟化氢分子中的氢原子之间能形成氢键,可表示为 F-H…O,氟原子和水分子中的氢原子能形成氢键可表示为O-H…F,氧原子和另一个水分子中的氢原子能形成氢键可表示为O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(5)氧族元素中非金属性O>S>Se,元素的非金属性越强,其氢化物的稳定性越强,所以这三种元素的氢化物中稳定性H2O>H2S>H2Se,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,水中含有氢键,熔沸点最高,则这三种氢化物的熔沸点H2O>H2Se>H2S,
故答案为:元素的非金属性越强,其氢化物的稳定性越强,非金属性O>S>Se,所以稳定性H2O>H2S>H2Se;氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,水中含有氢键,所以熔沸点H2O>H2Se>H2S.
点评 本题考查物质结构和性质,为高频考点,涉及氢化物稳定性及熔沸点比较、氢键表示方法、微粒空间构型判断、原子核外电子排布等知识点,明确基本原理及原子结构是解本题关键,注意氢键的表示方法,为易错点.

 字词句段篇系列答案
字词句段篇系列答案| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
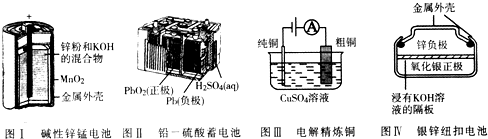
| A. | 图I所示电池中,锌极电极反应为Zn-2e-═Zn2+ | |
| B. | 图Ⅱ所示电池放电过程中,每转移1mo1电子,生成1mol PbSO4 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图Ⅳ所示电池中,Ag2O在电池工作过程中被氧化为Ag |
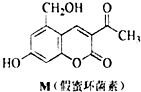
| A. | M的分子式为C12H10O5 | |
| B. | M与Br2只能发生取代反应,不能发生加成反应 | |
| C. | 1 mol M最多能与3mol NaOH反应 | |
| D. | M既能与FeCl3溶液发生反应,也能与CH3COOH发生反应 |
| A. | 无色透明的溶液中:Na+、MnO4-、NO3-、Br- | |
| B. | 0.1 mol•L-1CaCl2溶液中:Mg2+、NH4+、CO32-、SO42- | |
| C. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Fe2+、NO3-、Cl- |
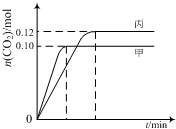 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示:
| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO (g) | CO (g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40% |
| 序号 | 操作及现象 | 结论 |
| A | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将1mL KSCN溶液与1mL 同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 | 证明溶液中存在平衡:Fe3++3SCN?Fe(SCN)3 |
| A. | A | B. | B | C. | C | D. | D |
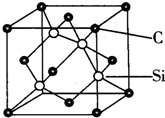 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: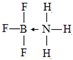 .
.