题目内容
下列各装置中,能够成原电池的是( )
A、 乙醇 |
B、 稀硫酸 |
C、 稀硫酸 |
D、 稀硫酸 稀硫酸 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,只要符合原电池构成条件即可形成原电池.
解答:
解:A.乙醇是非电解质,该装置不能自发的进行氧化还原反应,所以不能构成原电池,故A错误;
B.该装置电极材料相同,所以不能构成原电池,故B错误;
C.该装置符合原电池的构成条件,所以能构成原电池,铁易失电子作负极,碳作负极,故C正确;
D.该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选C.
B.该装置电极材料相同,所以不能构成原电池,故B错误;
C.该装置符合原电池的构成条件,所以能构成原电池,铁易失电子作负极,碳作负极,故C正确;
D.该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选C.
点评:本题考查了原电池原理,熟悉原电池的构成条件是解本题关键,注意这几个条件必须同时具备,缺一不可,题目难度不大.

练习册系列答案
相关题目
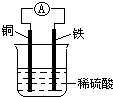 如图为铜铁原电池示意图,下列有关说法正确的是( )
如图为铜铁原电池示意图,下列有关说法正确的是( )| A、铜棒逐渐溶解 |
| B、该装置能将电能转化为化学能 |
| C、电子由铁棒通过导线流向铜棒 |
| D、正极反应为Fe-2e-=Fe2+ |
能正确表示下列化学变化的离子方程式是( )
| A、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气与溴化钠溶液反应:Cl2+2Br-=Br2+2Cl- |
| C、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| D、三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- |
有同温、同压、同体积的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO和CO2所含氧原子的个数比是( )
| A、1:2 | B、2:1 |
| C、1:1 | D、1:4 |
下列反应属于置换反应的是( )
| A、CaO+H2O=Ca(OH)2 |
| B、Fe2O3+3CO=2Fe+3CO2 |
| C、Cl2+2KBr=2KCl+Br2 |
| D、Na2CO3+BaCl2=2NaCl+BaCO3↓ |
为了改善空气质量,必须控制大气中污染物的排放量.下列物质中,未列入我国空气质量报告的是( )
| A、二氧化硫 | B、二氧化碳 |
| C、二氧化氮 | D、可吸入颗粒物 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是( )
| A、标准状况下,0.4gH2含氢分子数为0.2×6.02×1023 |
| B、32g O2中含有的氧原子数为2×6.02×1023 |
| C、1mol Na2O2与足量水反应转移电子数为6.02×1023 |
| D、标准状况下,22.4L H2O含水分子数为6.02×1023 |