题目内容
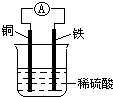 如图为铜铁原电池示意图,下列有关说法正确的是( )
如图为铜铁原电池示意图,下列有关说法正确的是( )| A、铜棒逐渐溶解 |
| B、该装置能将电能转化为化学能 |
| C、电子由铁棒通过导线流向铜棒 |
| D、正极反应为Fe-2e-=Fe2+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,该电池为铜铁原电池,Fe作负极,Cu作正极,发生Fe+2H+=Fe2++H2↑,电子由负极流向正极,以此来解答.
解答:
解:A.铜铁原电池中,铜是电池的正极,Fe是负极,Fe逐渐溶解,故A错误;
B.该装置为铜锌原电池,是把化学能转化为电能的装置,故B错误;
C.铜铁原电池中,铜是电池的正极,Fe是负极,电子由Fe流向Cu,故C正确;
D.Fe作负极,Fe原子失去电子发生氧化反应,则负极的反应为Fe-2e-=Fe2+,故D错误;
故选C.
B.该装置为铜锌原电池,是把化学能转化为电能的装置,故B错误;
C.铜铁原电池中,铜是电池的正极,Fe是负极,电子由Fe流向Cu,故C正确;
D.Fe作负极,Fe原子失去电子发生氧化反应,则负极的反应为Fe-2e-=Fe2+,故D错误;
故选C.
点评:本题考查原电池的工作原理,明确发生的原电池反应是解答本题的关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列4种化合物从化学性质上看,有1种与其他3种明显不同,这种物质是( )
| A、CaO |
| B、SO3 |
| C、CuO |
| D、K2O |
下列措施一定能增大化学反应速率的是( )
| A、增大反应物浓度 |
| B、降低温度 |
| C、减小反应物的浓度 |
| D、使用催化剂 |
某研究性学习小组的同学做了一个趣味实验:将一只鸡蛋放入食醋中,过一会发现蛋壳表面附有气泡,第二天蛋壳就变软了.你认为鸡蛋壳与食醋发生反应的离子方程式正确的是( )
| A、CO32-+2H+→H2O+CO2↑ |
| B、CaCO3+2H+→Ca2++H2O+CO2↑ |
| C、CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| D、CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑ |
下列各装置中,能够成原电池的是( )
A、 乙醇 |
B、 稀硫酸 |
C、 稀硫酸 |
D、 稀硫酸 稀硫酸 |
 下列反应前后物质的总能量变化可用如图表示的是( )
下列反应前后物质的总能量变化可用如图表示的是( )| A、石灰石在高温下的分解反应 |
| B、生石灰和水的反应 |
| C、盐酸与氢氧化钠溶液的反应 |
| D、木炭在氧气中燃烧 |

 和HOCH2CH2OH两种单体可通过
和HOCH2CH2OH两种单体可通过
 【化学反应原理(选修4)】
【化学反应原理(选修4)】