题目内容
4.下列有关元素周期表(律)说法正确的是( )| A. | 最外层有两个电子的原子一定在IIA 族 | |
| B. | IA族均为碱金属 | |
| C. | 同一周期核电荷数越大原子半径越大 | |
| D. | 同一主族核电荷数越大元素金属性越强 |
分析 A、原子最外层有两个电子,可能为He或某些过渡金属元素;
B、第ⅠA族元素除碱金属外还包括氢元素;
C、同一周期核电荷数越大原子半径越小;
D、同一主族的元素从上到下金属性逐渐增强;
解答 解:A、原子最外层有两个电子,可能为He或某些过渡金属元素,不一定为第IIA元素的原子,故A错误;
B、第ⅠA族元素除碱金属外还包括氢元素,故B错误;
C、同一周期核电荷数越大原子半径越小,而不是越大,故C错误;
D、同一主族的元素从上到下,原子半径逐渐增大,原子核对最外层电子的吸引力减弱,则金属性逐渐增强,故D正确;
故选D.
点评 本题考查了位置结构性质的相互关系及应用,为高考常见题型,侧重于学生的分析能力的考查,熟悉元素周期表结构及原子结构是解本题关键,结合元素周期律来分析解答,注意把握元素的性质与元素周期表的关系,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.常温下测得浓度为0.1mol•L-1的下列三种溶液的pH:下列法正确的是( )
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
| A. | 阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 | |
| B. | 相同条件下的酸性:H2CO3<HCN | |
| C. | 三种溶液中均存在电离平衡和水解平衡 | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 ol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
15.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状况下,7.8g苯中含有的碳碳双键数是0.3NA | |
| B. | 标准状况下,11.2L四氯甲烷所含分子数为0.5NA | |
| C. | 常温常压下,14g乙烯分子中含有的碳碳键数目为2NA | |
| D. | 1mol氢氧根离子(OH-)所含电子数为10NA |
19.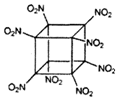 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )| A. | 分子中C、N间形成极性共价键 | B. | 1mol该分子中含8mol-NO2 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、CO2、H2O |
9.下列说法正确的是( )
| A. | 3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定 | |
| B. | 由1 mol H2形成2 mol H要放出热量 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2Q kJ/mol | |
| D. | 已知Ni(CO)4(g)=Ni(s)+4CO(g)△H=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g)△H=-Q kJ/mol |
16.氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡.
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此反应的a>0,△S>0.(填“>”“<”或“=”)
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.
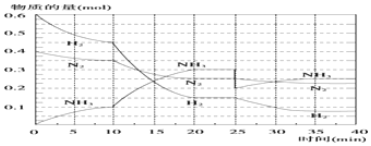
①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.

①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
13.以下是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐的饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\stackrel{Ⅳ}{→}$纯碱.
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐的饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\stackrel{Ⅳ}{→}$纯碱.
| A. | 第Ⅱ步的离子方程式为Na++NH3.H2O+CO2═NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
 .
.