题目内容
14.常温下测得浓度为0.1mol•L-1的下列三种溶液的pH:下列法正确的是( )| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
| A. | 阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 | |
| B. | 相同条件下的酸性:H2CO3<HCN | |
| C. | 三种溶液中均存在电离平衡和水解平衡 | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 ol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
分析 浓度均为0.1mol•L-1的NaHCO3、Na2CO3、NaCN三种盐溶液,PH都不等于7,说明它们发生了水解,盐类水解的规律是:无弱不水解,有弱才水解,越弱越水解,谁强显谁性.
A.NaHCO3、Na2CO3、NaCN三种盐,都是强电解质,都完全电离;
B.浓度均为0.1mol•L-1的NaHCO3、Na2CO3、NaCN三种盐溶液PH:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3),说明Na2CO3水解程度最大,NaCN次之,NaHCO3水解程度最小;
C. 弱电解质(水也是弱电解质)溶于水时,其分子可以微弱电离出离子;同时,溶液中的相应离子也可以结合成分子.当两者的反应速率相等时,溶液便达到了电离平衡;
D.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液得到等浓度的碳酸氢钠和碳酸钠混合溶液,碳酸根离子水解程度大于碳酸氢根离子,溶液显碱性;
解答 解:A.NaHCO3、Na2CO3、NaCN三种盐,都是强电解质,它们的电离方程式分别为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- (非常微弱),Na2CO3=2Na++CO32-,NaCN═Na++CN-,从它们的电离方程式可以看出,当浓度相同时,Na2CO3 电离出的阳离子Na+浓度大,考虑水解产生的阳离子;阴离子水解产生阴离子,所以,从上述方程式可看出,阳离子的物质的量浓度之和:Na2CO3>NaHCO3>NaCN,故A错误;
B.NaHCO3的水解离子方程式为:HCO3-+H2O?H2CO3+OH-,Na2CO3的水解离子方程式分两步,第一步为:CO32-+H2O?HCO3-+OH-(以第一步为主),第二步为:HCO3-+H2O?H2CO3+OH-,NaCN的水解离子方程式为:CN-+H2O?HCN+OH-,盐类水解的规律是,越弱越水解,即酸越弱,其盐中的酸根离子水解程度越大.浓度均为0.1mol•L-1的NaHCO3、Na2CO3、NaCN三种盐溶液PH:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3),说明酸性:H2CO3>HCN.故B错误;
C.浓度均为0.1mol•L-1的NaHCO3、Na2CO3、NaCN三种盐溶液,PH都不等于7,说明存在水解平衡.
它们的盐溶液,都有水,水也是弱电解质,说明存在电离平衡.故C正确;
D.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液得到等浓度的碳酸氢钠和碳酸钠混合溶液,碳酸根离子水解程度大于碳酸氢根离子,溶液显碱性,离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题主要考查了盐类水解的规律,解题时需掌握盐类水解的原理,以及水解的盐溶液中,各种离子浓度的大小的定性分析的方法,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
| A. | 在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多 | |
| B. | 人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2 | |
| C. | 水玻璃可用于生产粘合剂和防火剂 | |
| D. | 自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用 |
| A. | 最外层有两个电子的原子一定在IIA 族 | |
| B. | IA族均为碱金属 | |
| C. | 同一周期核电荷数越大原子半径越大 | |
| D. | 同一主族核电荷数越大元素金属性越强 |
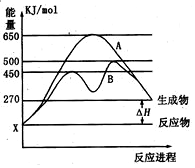 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1