题目内容
8.镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:①Ni(S)+4CO(g)$\stackrel{50℃}{?}$ Ni(CO)4(g)+Q
②Ni(CO)4(g)$\stackrel{230℃}{?}$ Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有增大压强、从反应体系中移走Ni(CO)4(g).
(2)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时bc.
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大.
分析 (1)反应Ni(S)+4CO(g)?Ni(CO)4(g)+Q是放热反应,反应前后气体体积减小,依据平衡移动原理分析;
(2)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小.
解答 解:(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、从反应体系中移走Ni(CO)4(g)等措施均可使反应正向进行,提高Ni(CO)4的产率,
故答案为:增大压强;从反应体系中移走Ni(CO)4(g);
(2)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小,
a.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行,平衡常数减小,故a错误;
b.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行一氧化碳浓度减小,故b正确;
c.依据反应分析,温度降低反应①平衡正向进行,反应②逆向进行,镍质量减小,故c正确;
d.平衡逆向进行,温度降低,v逆[Ni(CO)4]减小,故d错误;
故答案为:bc.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确化学平衡及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列有关说法正确的是( )
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
5.黄酒在存放过程中,有部分乙醇转化为乙酸,导致黄酒变酸.该过程中发生的反应为( )
| A. | 取代反应 | B. | 氧化反应 | C. | 加成反应 | D. | 酯化反应 |
13.25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa).在此温度下向20mL0.1mol•L-1H2R溶液中滴加0.1mol•L-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示.
下列有关说法正确的是( )
下列有关说法正确的是( )

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
20.分子式为C4H8属于链状烃的一溴代物的数目有( )
| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
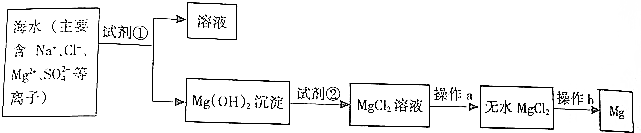
17. 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是sp3,离子化合物YX5的电子式是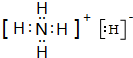 .
.
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是2个.
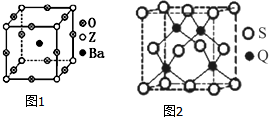
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐).A晶体的晶胞为正方体(如图1).
①制备A的化学反应方程式是TiO2+BaCO3═BaTiO3+CO2↑;
②在A晶体中,Z的配位数为6;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的面心.
(4)R2+离子的外围电子层电子排布式为3d9.R2O的熔点比R2S的高(填“高”或“低”).
(5)Q元素和硫(S)元素能够形成化合物B.B晶体的晶胞为正方体(如图2),若晶胞棱长为540.0pm,则晶胞密度为$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g•cm-3(列式并计算).
 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
(1)YX3中心原子的杂化轨道类型是sp3,离子化合物YX5的电子式是
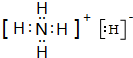 .
.(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是2个.
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐).A晶体的晶胞为正方体(如图1).
①制备A的化学反应方程式是TiO2+BaCO3═BaTiO3+CO2↑;
②在A晶体中,Z的配位数为6;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的面心.
(4)R2+离子的外围电子层电子排布式为3d9.R2O的熔点比R2S的高(填“高”或“低”).
(5)Q元素和硫(S)元素能够形成化合物B.B晶体的晶胞为正方体(如图2),若晶胞棱长为540.0pm,则晶胞密度为$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g•cm-3(列式并计算).