题目内容
9.NA表示阿佛加德罗常数的值,下列关于0.2mol/LK2SO4溶液的说法正确的是( )| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+浓度为0.2 mol/L | |
| D. | 1L溶液中SO42-的浓度为0.4 mol/L |
分析 A.根据n=cV计算硫酸钾的物质的量,然后计算出含有钾离子和硫酸根离子的物质的量及数目;
B.根据A的计算结果可知含有钾离子的物质的量及数目;
C.根据c(K+)=2c(K2SO4)计算;
D.根据c(SO42-)=c(K2SO4)计算.
解答 解:A.500mL0.2mol/LK2SO4溶液中含有硫酸钾的物质的量为:0.2mol/L×0.5L=0.1mol,0.1mol硫酸钾中含有0.2mol钾离子、0.1mol硫酸根离子,总共含有0.3mol离子,含有K+、SO42-总数为0.3NA,故A正确;
B.根据A可知,500mL溶液中含有0.2mol钾离子,含有0.2NA个K+,故B错误;
C.1L溶液中K+浓度为:c(K+)=2c(K2SO4)=0.4 mol/L,故C错误;
D.1L溶液中SO42-的浓度为:c(SO42-)=c(K2SO4)=0.2 mol/L,故D错误;
故选A.
点评 本题考查物质的量的计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
20.药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )


| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
17.下列微粒的结构示意图中氧族元素原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
1.以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料可制备金属镁和溴.流程如图1:
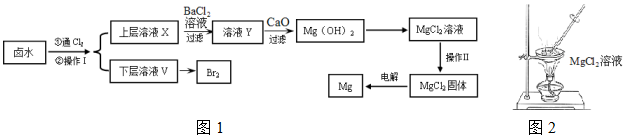
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
(5)操作Ⅱ用图2所示操作不能实现(填“能”或“不能”).原因是MgCl2+2H2O?Mg(OH)2+2HCl(用化学方程式解释).
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
19.下列有关化学用语的表示正确的是( )
| A. | H2O2的电子式: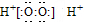 | |
| B. | 氮原子最外层电子轨道表达式: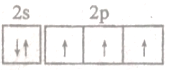 | |
| C. | Cl中子数为18的氯原子结构示意图: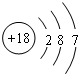 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
 Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:


