题目内容
17.下列说法正确的是:( )| A. | 工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 | |
| B. | 心脏起搏器中使用的新型Li-I2 电池的寿命已超过10年,其反应可简单表示为2Li+I2═2LiI,阴极反应为:2Li-2e-═2Li+ | |
| C. | 为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 | |
| D. | 某物质的溶解度为难溶,则该物质不溶于水. |
分析 A.阳极中比Cu活泼的金属会放电形成离子进入溶液,不如Cu活泼的金属会脱离阳极,形成阳极泥,而阴极析出的金属为Cu;
B.新型Li-I2 电池属于原电池,两极为正极、负极,负极发生氧化反应,而电解池两极为阳极、阴极;
C.Zn比Fe活泼,Zn为负极,Fe为正极,Zn被腐蚀,Fe被保护;
D.某物质的溶解度为难溶,说明溶解度很小,不是说溶解度为0.
解答 解:A.阳极中比Cu活泼的金属会放电形成离子进入溶液,不如Cu活泼的金属会脱离阳极,形成阳极泥,而阴极析出的金属为Cu,根据电子转移守恒可知,在电解精练时,阳极减少的质量大于阴极增加的质量,故A错误;
B.新型Li-I2 电池属于原电池,两极为正极、负极,负极发生氧化反应,负极反应为:2Li-2e-═2Li+,不是阴极反应式,故B错误;
C.Zn比Fe活泼,Zn为负极,Fe为正极,Zn被腐蚀,Fe被保护,为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌,故C正确;
D.某物质的溶解度为难溶,说明溶解度很小,不是说该物质不溶于水,不是说溶解度为0,故D错误,
故选:C.
点评 本题考查电解原理应用、原电池、金属腐蚀与防护、溶解度等,比较基础,理解原电池与电解池工作原理.

练习册系列答案
相关题目
6.下列关于铷(Rb)的叙述中,正确的是( )
| A. | 铷的密度比钠小,熔点比钠高 | |
| B. | 铷与冷水不反应,但与热水反应,并放出氢气 | |
| C. | 铷盐大多数易溶于水 | |
| D. | 铷的原子半径和离子半径都比钠小 |
8.串联电路中的四个电解池分别装有0.1mol•L-1的下列溶液,用铂电极电解,连接直流电源一段时间后,溶液的pH变小的是( )
| A. | 盐酸 | B. | NaCl | C. | AgNO3 | D. | KNO3 |
5.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
12.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
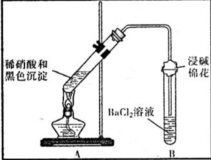 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
9.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 它与乙烯可能是同系物 | |
| B. | 一氯代物只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
6.下列说法正确的是( )
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
7.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 在水中溶解度 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 88 | 0.90 | 可溶 |
| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |