题目内容
15.在工农业生产和日常生活中经常用到的物质有下列几种:①Si ②NH4Cl ③Ca(ClO)2 ④Al(OH)3 ⑤Fe2O3.其中:电脑芯片中常用的物质是①(填序号,下同);用于杀菌、消毒的物质 是③;用作化肥的是②;用作红色油漆和涂料的是⑤;医用胃酸中和剂的是④.分析 ①Si可做为半导体,可以有很多特殊的功能;
②NH4Cl为氨盐
③Ca(ClO)2中+1价的氯具有强氧化性;
④Al(OH)3具有两性;
⑤Fe2O3是氧化物,颜色为红棕色;据此即可解答.
解答 解:①Si原子最外层电子为4个,既难得电子,也难失去电子,可做为半导体,可用于制造硅芯片;
②NH4Cl含有氮元素,氮元素为植物生长必需的营养元素,为氨盐,可用作化肥;
③Ca(ClO)2中+1价的氯具有强氧化性,能与还原性物质作用变成-1价的氯,可用于杀菌、消毒;
④Al(OH)3具有两性,作为酸时,酸性较弱,作为碱时,碱性较弱,胃酸的成分为盐酸,氢氧化铝显弱碱性,和盐酸发生中和反应,Al(OH)3医疗上可用作胃酸中和剂;
⑤Fe2O3是氧化物,颜色为红棕色,俗称为铁红,可用作红色油漆和涂料;
故答案为:①;③;②;⑤;④.
点评 本题主要考查了元素硅、氮、氯、铝、铁及其化合物的知识,较为简单,平时应多注意积累相关知识.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
5.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
6.下列说法正确的是( )
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
3.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
10.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ba2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
7.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 在水中溶解度 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 88 | 0.90 | 可溶 |
| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
5.SO2既有氧化性又有还原性,通常以还原性为主,Fe3+和Cr2O72-具有氧化性.将SO2与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,前后依次发生两个氧化还原反应.据此下列有关说法正确的是( )
| A. | 还原性:Cr3+>Fe2+>SO2 | |
| B. | 氧化性:Cr2O72->SO2>Fe3+ | |
| C. | 足量的SO2也不能使Fe2(SO4)3溶液完全褪去颜色 | |
| D. | Fe2(SO4)3在前一个反应中做氧化剂,后一个反应中做还原剂 |
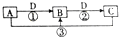 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题: