题目内容
实验室里迅速制备少量氯气可利用以下反应:
KMnO4+ HCl-- KCl+ MnCl2+ Cl2↑+ H2O
(1)请配平上述化学方程式,并在上面用“双线桥”标明电子转移的方向和数目:
(2)该反应的氧化产物是 ,KMnO4发生 反应.
(3)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为 mol,转移电子数为 .
(1)请配平上述化学方程式,并在上面用“双线桥”标明电子转移的方向和数目:
(2)该反应的氧化产物是
(3)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,再根据元素守恒确定其它物质的系数,配平方程式,根据“双线桥法”标明电子转移的方向和数目;
(2)还原剂通过氧化反应生成的物质为氧化产物;反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4发生还原反应;
(3)根据n=
计算氯气的物质的量,被氧化的HCl为生成Cl2,根据氯元素守恒计算被氧化的HCl,根据方程式计算需要高锰酸钾的质量,根据氯气的物质的量计算转移电子物质的量,再根据N=nNA计算转移的电子数目.
(2)还原剂通过氧化反应生成的物质为氧化产物;反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4发生还原反应;
(3)根据n=
| V |
| Vm |
解答:
解:(1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O,用“双线桥法”标明电子转移的方向和数目为: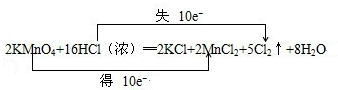 ;
;
故答案为:2、16、2、2、5、8;
(2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物;
反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应;
故答案为:Cl2;还原;
(3)560mlCl2的物质的量为
=0.025mol,被氧化的HCl为生成Cl2,根据氯元素守恒可知被氧化的HCl为0.025mol×2=0.05mol;
反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA;
故答案为:0.05;0.05NA.
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O,用“双线桥法”标明电子转移的方向和数目为:
 ;
;故答案为:2、16、2、2、5、8;

(2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物;
反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应;
故答案为:Cl2;还原;
(3)560mlCl2的物质的量为
| 0.56L |
| 22.4L/mol |
反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA;
故答案为:0.05;0.05NA.
点评:本题考查氧化还原反应配平和基本概念、有关计算等,难度中等,注意掌握氧化还原反应配平常用方法.

练习册系列答案
相关题目
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验中使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从分液漏斗上口倒出 |
能正确表示下列反应的离子方程式为( )
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
下列推断正确的是( )
| A、Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| B、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、SiO2 是酸性氧化物,能与NaOH溶液反应 |
X、Y、Z、M、W原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,Z与其同主族的短周期无素可形成一种常见气体,X、Y、Z3种元素形成化合物甲,下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物甲中可能含有离子键和共价键 |
| C、由W元素形成的单质在自然界的贮量丰富,并存在大量的单质 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |