题目内容
在直接以甲醇为燃烧电池中,电解质溶液为酸性,负极的反应式为 .已知CH3OH(l)的燃烧热△H=-726.5kJ?mol-1,理想状态下,该燃烧电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为 (燃料电池的理论效率:指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
考点:化学电源新型电池
专题:电化学专题
分析:甲醇燃料电池,甲醇在负极失电子发生氧化反应生成二氧化碳;根据甲醇的燃烧热计算2mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算.
解答:
解:酸性条件下甲醇被氧化生成二氧化碳,电极方程式为CH3OH+H2O-6e-═CO2+6H+;该燃料电池的理论效率为
×100%=96.6%.
故答案为:CH3OH+H2O-6e-═CO2+6H+;96.6%.
| 702.1kJ |
| 726.5kJ |
故答案为:CH3OH+H2O-6e-═CO2+6H+;96.6%.
点评:本题考查了原电池原理,明确正负极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式要结合溶液的酸碱性书写,为易错点.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
| A、CuCl2[CuO] |
| B、NaOH[Na2O] |
| C、NaCl[HCl] |
| D、CuSO4[Cu(OH)2] |
已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的( )
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
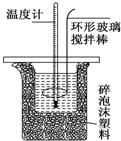 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.