题目内容
20.已知1.204×1023个X气体的质量是6.4g.则X气体的摩尔质量是32g/mol.分析 根据物质的量与阿伏伽德罗常数的关系:n=$\frac{N}{N{\;}_{A}}$,计算出气体的物质的量,再根据摩尔质量表达式:M=$\frac{m}{n}$,计算出X气体的摩尔质量.
解答 解:1.204×1023个X气体分子的物质的量为:n=$\frac{N}{{N}_{A}}$=$\frac{1.204×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.2mol,X气体的摩尔质量为:M=$\frac{m}{n}$=$\frac{6.4g}{0.2mol}$=32g/mol.
故答案为:32g/mol.
点评 本题考查了有关物质的量的计算,能灵活运用公式是解本题的关键,难度不大,注意摩尔质量的单位是g/mol.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
12.分别进行如下表所示实验,根据实验现象得出的结论正确的是( )
| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
11.下列关于1mol•L-1硫酸溶液的说法中正确的是( )
| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
8.氮氧化合物对环境的损害作用极大.下列环境问题中氮氧化合物不是“重要成员”的是( )
| A. | 酸雨 | B. | 光化学烟雾 | C. | 臭氧空洞 | D. | 温室效应 |
15.下列叙述正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
12.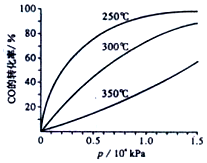 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:
I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
(1)该反应的平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; 反应在0-t1 min内的平均速率为v(H2)=$\frac{0.3}{{t}_{1}}$mol/(L.min)
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
9.用惰性电极实现电解,下列说法正确的是( )
| A. | 电解稀硫酸,实质是电解水,溶液pH不变 | |
| B. | 电解氢氧化钠稀溶液,溶液浓度增大,pH变小 | |
| C. | 电解氯化钠溶液,溶液浓度减小,pH不变 | |
| D. | 电解硫酸铜溶液,要消耗OH-溶液,pH变小 |
10.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
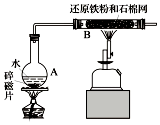 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)