题目内容
2.0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.3mol,则该烃的分子式为C3H6.该烃能使溴水褪色,写出反应方程式CH3CH=CH2+Br2→CH3CHBrCH,该反应属于加成反应(填反应类型)分析 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.3mol,说明有机物含有3个C原子、6个H原子,该烃能使溴水褪色,说明含有碳碳双键,应为烯烃,以此解答该题.
解答 解:n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.3mol:0.3mol×2=1:3:6,即1个分子中含有3个C原子、6个H原子,故该烃的分子式为:C3H6,该烃能使溴水褪色,说明含有碳碳双键,应为烯烃,即丙烯,可与溴水发生加成反应,方程式为CH3CH=CH2+Br2→CH3CHBrCH,
故答案为:C3H6;CH3CH=CH2+Br2→CH3CHBrCH;加成反应.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意明确质量守恒在确定有机物分子式中的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列用来表示物质变化的反应式中,正确的是( )
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
8.常温下,在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )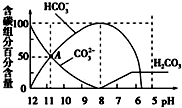

| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
14.下列化学用语表示正确的是( )
| A. | 硫原子的结构示意图: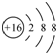 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 二氧化碳分子的电子式: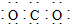 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
11.1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2$→_{①}^{O_{2}/Ag}$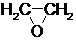 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
(1)通过反应①用乙烯和空气混合气体制备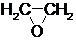 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.
计算此时乙烯的转化率.
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
CH2=CH2$→_{①}^{O_{2}/Ag}$
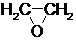 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH(1)通过反应①用乙烯和空气混合气体制备
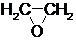 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.| C2H4 | O2 | N2 |  | |
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
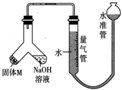 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.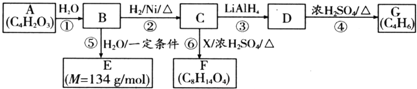
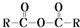 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH 、
、 .
.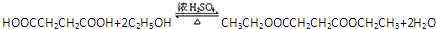 .
.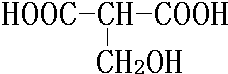 、
、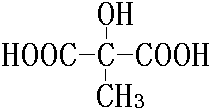 .
.