题目内容
7.某气态烃A和B按2:3(体积比)混合后,取0.1mol与一定量氧气混合燃烧,产物为CO、CO2和水蒸气.将燃烧产物依次通过足量的浓硫酸、灼热的CuO及碱石灰,最后碱石灰增重7.04g.求A和B可能的分子式.分析 碱石灰吸收的CO2包括燃烧生成的CO2及CO转化(还原CuO)成的CO2,即0.1mol混合烃中的C转化成CO2的总量,共为$\frac{7.04g}{44g/mol}$=0.16mol,1mol混合烃含碳1.6mol,所以混合烃一定含CH4,结合气态烃A和B按2:3的比值计算该题.
解答 解:碱石灰吸收的CO2包括燃烧生成的CO2及CO转化(还原CuO)成的CO2,即0.1mol混合烃中的C转化成CO2的总量,共为$\frac{7.04g}{44g/mol}$=0.16mol,
可知:1mol混合烃含碳1.6mol,所以混合烃一定含CH4,
设另一烃分子中含x个碳原子
(1)令A为CH4,则有$\frac{x-1.6}{0.6}$=$\frac{2}{3}$,解得x=2,B可能是C2H6、C2H4、C2H2.
(2)令B为CH4,则有$\frac{x-1.6}{0.6}$=$\frac{3}{2}$,x=2.5,不符合题意,
答:A的分子式为CH4,B的分子式可能为C2H 6、C2H 4、C2H2.
点评 本题考查有机物的计算,为高频考点,侧重于学生分析、计算能力的考查,注意把握混合物的计算方法,把握计算思路,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
9.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
6.下列实验方法正确的是( )
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
12.关于粗盐提纯的下列说法中正确的是( )
| A. | 开始析出晶体后用玻璃棒搅拌 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
19.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
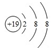
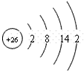
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: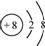 | |
| C. | NaCl的电子式: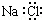 | |
| D. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl |
16.有八种物质:①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
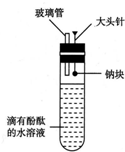 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: .
.
 .
.